本文主要是介绍NBR最新:多模态数据融合下人际神经同步的神经生物学基础,希望对大家解决编程问题提供一定的参考价值,需要的开发者们随着小编来一起学习吧!
导读
人类彼此同步以促进成功的互动。在这里,本研究使用了一种多模态数据融合方法,旨在阐明人际神经同步(INS)发生的神经生物学机制。本研究对22项fMRI和69项fNIRS超扫描实验(分别为740名和3721名被试)的元分析显示,INS在右侧颞顶交界处和左腹侧前额叶皮层存在稳定的脑区相关性。将这些元分析信息与公共数据库、生物行为和脑功能关联分析相结合发现,INS涉及与心智化和注意力网络有功能连接的感觉整合枢纽。在分子和遗传水平上,本研究发现INS与GABA能神经传递和IV/V层神经元回路、发育基因表达模式延长和神经发育障碍相关。尽管受限于表型-分子关联分析的间接性质,但本研究的发现为INS的神经生物学基础提出了新的可检验假设。
前言
与环境同步是大多数生物适应不同环境条件的关键机制,这可能提供了一种进化优势。人类对他人的适应是一种核心的生存机制,并与人类社会互动期间在多个生物行为水平上发生的人际同步有关。人际同步涉及人与人之间行为、生理或激素活动的协调,可能代表适应能力,使人类能够访问他人的内部唤醒状态,分享和调节情绪,增加社会关联、同理心和亲社会承诺,促进学习,并适应集体行为和群体规范。揭示人际同步背后的神经生物学将有助于我们理解人类适应他人和与他人互动的基本机制。了解这些机制如何运作和如何失败,一方面对教育科学、发育和社会神经科学具有广泛的影响,另一方面对群体内和群体间冲突研究和精神卫生保健具有广泛的影响。
人际同步已扩展到互动个体的神经活动,通常称为人际神经同步(INS)、脑间同步或脑-脑同步。在单个大脑中,神经元的节律振荡可能通过兴奋状态的同步导致神经元信号的一致性,从而实现神经元的信息传递和相互作用。局部神经元振荡与兴奋-抑制(E/I)平衡有关,由 GABA能神经元和谷氨酸能神经元群调节,这也可能是远程同步的驱动因素。在电生理学上,脑内同步可能由兴奋性皮质-皮质连接以及皮质下结构(尤其是丘脑)驱动。在整个大脑中,类似于单个神经元的振荡,我们的大脑及其感觉系统也可能有节奏地从环境中采样信息。信息传递不是通过直接的身体接触来实现的,而是通过个人运动系统产生的动作(例如,言语、声音、手势或眼神接触)间接实现的。这些动作通过环境传播,并由互动伙伴的感觉系统进行采样。在成对或组中的每个个体,节律性神经元振荡可能会同步。
通过同时记录来自两个或多个被试的大脑,称为超扫描,可以量化个体进行人际互动时大脑信号的时间和空间相似性。或者,根据第一个人预先记录的刺激,一个接一个地被扫描,这通常被称为伪超扫描。在方法学上,人类超扫描实验已经在全光谱无创脑电和血流动力学成像技术中进行,其中脑电图(EEG)、功能性近红外光谱(fNIRS)和功能性磁共振成像(fMRI)的应用最为广泛。
先前的人类超扫描研究发现了多种与INS相关的脑区,包括内侧前额叶皮层(PFC)、前扣带回、颞上回(STG)和右侧颞顶交界处(rTPJ)以及岛叶皮层。对13项涉及人际合作的fNIRS超扫描研究的首次元分析评估证实了PFC和TPJ中存在INS。观察到的脑区模式表明,大脑网络与心智化、社会认知和互动、预测编码和镜像有关。这些模式表明INS涉及复杂的认知过程,包括心理理论(ToM)、心理建模、预测、模拟以及行为和情感状态的模拟。
从发展角度来看,INS可能植根于人类生命的早期,照顾者与婴儿的同步互动对于建立亲缘关系和影响长期发育结果至关重要。在认知和功能层面上,INS被嵌入到一个预测编码框架中,由观察-执行/校准、错误监测和奖励系统组成的三部分反馈回路介导,该回路被认为是被成功校准激活并加强校准的。正如相互预测理论所假设的那样,在两个相互作用的伙伴中,大脑活动的一致模式可能来自共定位神经元(i)编码自我行为和(ii)编码对伙伴行为预测的神经活动之和。在神经生理学层面上,两个大脑之间或多个大脑之间的连接可能由社会接触形成,类似于Hebbian突触连接。在这里,一个被试从事某种行为的皮质活动将转化为一个互动被试的皮质活动,这种社会互动的重复不仅会重塑成对大脑间的功能连接,而且可能会在整个社会群体中重塑脑间功能连接。
快速发展的超扫描研究领域以及我们对人类社会能力的探索导致有越来越多的理论描述试图解释INS现象。然而,这些理论的基础仍然缺乏有力的证据,许多提议的框架还没有经过实证检验。特别是,由于缺乏实证数据,开发超越脑区域相关性的模型的尝试受到了限制。鉴于社会认知、催产素信号和E/I平衡被认为在神经生理水平上相互关联,这些潜在的脑内同步机制在多大程度上参与INS还有待探索。
本研究旨在确定一个共同的神经基质,并就INS的神经生理机制提出新的可检验假设。为了实现这一目标,本研究使用多模态数据融合技术作为整合成像、遗传和行为水平数据的强大工具。通过综合元分析技术、数据融合方法和基于零模型的假设检验(图1),本研究证实了rTPJ中INS的稳健空间收敛以及腹侧PFC的参与,并为GABA能神经传递和E/I平衡在人类INS中的潜在重要作用提供了首要证据。
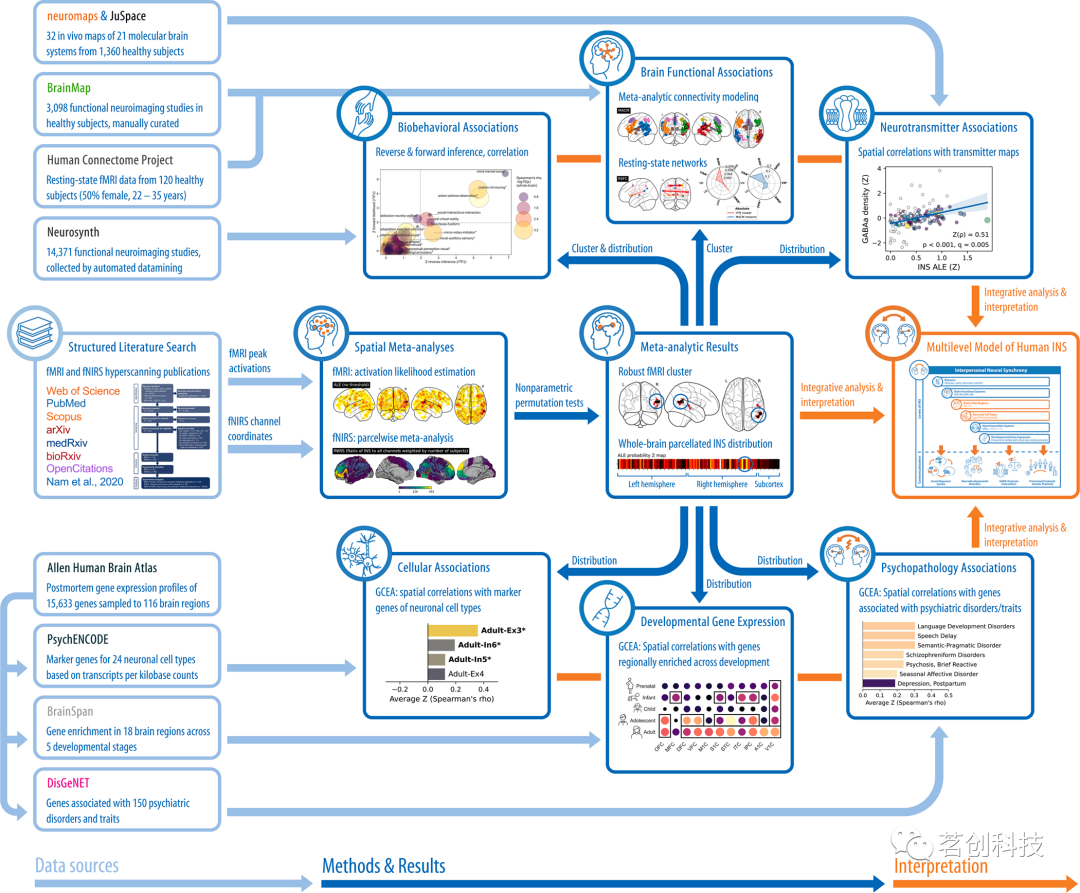
图1.探索人类INS神经生物学的多模态数据融合方法。该图概述了本研究中应用的多模态数据融合工作流程。描述了用于生成有关INS神经生物学基础的多层次知识和新假设的数据来源和主要分析步骤。缩写:INS=人际神经同步,fMRI=功能性磁共振成像,fNIRS=功能性近红外光谱,GCEA=基因类别富集分析。
材料和方法
首先,通过文献检索收集了目前可用的fMRI和fNIRS超扫描数据,并将其提交给空间元分析,以确定INS常见的脑区相关性。其次,基于INS的这些脑区相关性,本研究在脑区和全脑水平上评估了INS相关的脑功能网络和生物行为关联模式。第三,将本研究的结果扩展到分子水平,探索了全脑INS分布如何与神经递质系统相一致,以及空间相关的基因表达模式如何将INS与特定的神经元细胞类型、大脑发育和精神病理学相关联(图1)。
软件、代码和数据可用性
分析是在Python(3.8.8)和Matlab(R2021a)环境中进行的。使用了以下软件和软件包:文献检索:SetYouFree(0.0.1)、Cadima。神经成像元分析和图像处理:NiMARE(0.0.12rc7)、Nilearn(0.9.1)、AtlasReader(0.1.2)。FNIRS探针重建:AtlasViewer(2.12.12)。FMRI数据处理:CONN(20b)。核成像/mRNA表达数据检索和空间相关性分析:JuSpace(1.3)、neuromaps(0.0.2)、JuSpyce(0.0.1)、brainSMASH(0.11.0)、abagen(0.1.3)、ABAnnotate(0.1.0)。可视化:Nilearn、Matplotlib(3.4.3)、seaborn(0.11.2)、surfplot(0.1.0)、GO-Figure!(1.0.1)、pyvis(0.2.1)、WordCloud(1.8.1)。此外:scipy(1.8.1)、statsmodels(0.13.1)、numpy(1.22.3)、pandas(1.4.2)。
本研究所使用的代码和数据可在GitHub存储库 (https://github.com/LeonDLotter/MAsync) 中获取。人类连接组项目神经成像数据可以公开访问(https://db.humanconnectome.org)。所有代码都可以在带注释的Jupyter notebook中找到,该notebook在存储库中以HTML格式(https://leondlotter.github.io/MAsync/MAsync_analyses.html)提供。

文献检索和数据提取
在两步半自动文献检索中确定了目前已发表的fMRI和fNIRS超扫描实验。方法上,本研究专注于fMRI和fNIRS,因为这两种方法都依赖于血流动力学信号,提供了相对较高的空间分辨率(与EEG相比),并共同构成了目前最大的超扫描文献。下文将使用术语“出版物”来指代原始研究,使用“实验”来指代从独立研究对象获得的数据集,这些数据集可以涵盖来自多个出版物的数据。
①文献检索过程
基于PubMed、Web of Science和Scopus进行初步半结构化文献检索,并对Google学术引文列表进行了手动筛选,并在接下来的几个月中通过PubMed预警进行了更新。最终检索于2021年12月12日进行,使用SetYouFree(https://github.com/ChristianGerloff/set-you-free)通过PubMed、Scopus、arXiv、bioRxiv和medRxiv的开放访问API进行,然后对OpenCitations数据库中的结果记录进行前向和后向引用检索(不包括无摘要的记录)。两次文献检索的结果以及相关综述的参考文献被导入Cadima(https://www.cadima.info/)进行手动筛选、纳入评估,并根据PRISMA 2020指南做出最终纳入决策。首先,标题和摘要由五位独立评审员(LDL、LB、AN、JK和CG)中的一名进行筛选,然后由四名不了解彼此纳入/排除决策的评审员中的两名(LDL、LB、AN和JK)进行全文评估。
②研究纳入和数据提取
本研究检索了fMRI或fNIRS超扫描出版物,以评估全脑(fMRI)或通道(fNIRS)水平的时间同步性;健康成年人(18-65岁)的脑血流动力学信号单向或双向交互。虽然伪超扫描(通常是根据第一人称的预先记录刺激对一个又一个被试进行扫描)允许对实验刺激进行更精确的控制,但它可能无法完全捕捉到现实生活中社会互动所特有的潜在神经生物学表征。然而,本研究纳入了超扫描和伪超扫描研究,因为后者可能仍然揭示了社交互动的某些方面,例如,在两人交际环境中,听说话者的被试的单向交际方面可以被视为实际双向社交互动的一个子方面。
本研究感兴趣的是分析人际互动期间的INS与休息、控制或随机化条件的对比,与交互类型无关,因为本研究旨在确定INS的共同神经基质(例如,如果一项研究对比了合作、竞争和对照条件下的INS,那么将综合结果合作/竞争>对照纳入)。本研究还纳入了仅报告更具体对比的研究(例如,反馈后的INS>反馈前的INS),并在事后评估了这些研究的纳入如何影响元分析结果(仅与fNIRS研究相关)。在方法上,本研究纳入了与连接估计器(即时间序列相关性或预测,小波相干性)无关的研究,前提是该方法捕获了时间同步。如果研究调查了时间变化的被试时间序列的影响,本研究的目标是仅纳入反映零滞后关系的结果,以提高同质性。因此,本文研究的“显著INS”的广泛概念可以概括为人类在人际互动期间测量的脑源性血氧依赖信号相对于非互动条件下的时间变化的相似性。
fMRI实验的空间元分析
本研究使用激活似然估计(ALE)来识别INS的一致性空间相关性。简而言之,ALE通过将每个焦点与样本大小相关的高斯核卷积,提供了全脑的收敛图,并结合了从报告的INS焦点建模的实验水平的激活图。然后,非参数置换过程将INS焦点的真正收敛与随机空间模式(5000个排列)区分开来。
①ALE
所有基于坐标的元分析均使用神经成像元分析研究环境(NiMARE; https://github.com/neurostuff/NiMARE)进行。将来自同一样本(实验)的所有对比和坐标都连接起来。每个实验在2mm各向同性蒙特利尔神经研究所(MNI)-152空间中,通过高斯核函数对每个焦点进行卷积估计激活图。根据每个实验的样本量确定核的宽度,即高斯高度最大值的一半。如果同一实验的焦点重叠,则仅保留最大的体素值。这些实验水平数据的联合构成了元分析收敛图。基于经验推导的零分布确定体素统计显著性,使用p<.001阈值形成簇,并通过从灰质模板中随机绘制坐标来生成聚类质量的零分布(5000次迭代)。通过将实际聚类质量与聚类质量的零分布进行比较,为每个聚类分配一个FWE校正的p值,并通过将聚类映射阈值设定在−log10(p)>~1.3来保留显著的簇。
②单个实验的影响和发表偏倚的风险
为了估计实验对整体ALE结果的影响,本研究迭代计算实验x的贡献为

。由于非线性的ALE联合计算,这种方法并不精确,但从实际角度来看,它足以近似贡献并确定单个实验的夸大影响。然后,本研究计算了所有生成的阈值化和二值化映射的空间连接,以证明哪些聚类在每次迭代中持续存在。对发表偏倚的聚类稳健性估计为fail-safe-N。对于每个聚类,生成焦点对聚类没有贡献的噪声实验。
fNIRS实验的空间元分析
迄今为止,由于fNIRS领域在方法标准化和特定元分析技术的可用性方面仍然有限,本研究根据ALE方法开发了元分析fNIRS评估。简而言之,对于100个皮层区域中每一个,收集了在各自区域采样的fNIRS通道中是否观察到INS的信息,以及对这些信息有贡献的被试和实验数量。然后,计算了一个区域“fNIRS指数”,其中包含所有可用信息以供进一步评估,并通过随机化通道-区域分配(1000个排列)来检验区域的显著性。
①坐标提取和重建
大多数fNIRS研究使用标准格式的探针阵列,根据国际脑电定位系统中的坐标进行定位。通常用于获得大脑表面近似位置的方法是①使用一个或多个被试的解剖MRI扫描进行配准,②使用3D数字化仪对通道位置数字化后进行配准,或③基于光电阵列数字模型和参考数据库的虚拟配准。在可能的情况下,纳入作者报告或发送给我们的坐标。必要时,从数据库或同一研究小组开展的其他研究中获取坐标,或者使用AtlasViewer重建光极位置。该工作流失败的实验被排除在外。
②fNIRS数据分析
对于fNIRS数据,目前正在开发标准化的结果报告系统,并且没有特定的元分析技术可用。为了近似对fNIRS INS结果进行元分析评估,本研究使用100-parcel皮质体积图谱按区域汇总fNIRS数据。使用kd-树将最近的图谱parcel分配给每个fNIRS通道。然后,对于每个parcel,收集了通道总数、显示INS的通道数量以及相应的实验数量和贡献该信息的被试数量。为了比较parcel之间的结果,本研究使用了三个指数,计算公式为:

本研究关注第二个指数,因为它包含了所有可用的fNIRS数据。为了确定观测指数并非偶然概率最高的区域,研究者对通道-区域分配(1000次迭代)进行了排列,估计了每个区域和每个“fNIRS指数”的精确单侧p值,并对每个指数的区域应用FDR校正。与基于效应量的元分析相比,研究者更喜欢这种类似于ALE的方法,因为前者因其方法学的异质性而严重限制了符合条件的研究。将转换后的结果在fsaverage表面模板上进行可视化。通过使用分割水平数据而不是体素水平数据,旨在近似fNIRS数据的空间分辨率,同时考虑到由于事后重建通道坐标而没有关于头部形状、大小和探针定位的详细信息而增加的空间不确定性。其次,通过ALE评估fNIRS焦点和fMRI焦点,对所有神经成像数据进行了联合元分析。为了使ALE方法适用于fNIRS数据,在所有fNIRS实验中都保持ALE核大小为10mm FWHM,因为ALE核的样本量-FWHM函数是针对MRI数据开发的。为了进一步将fNIRS数据的空间不确定性纳入到本研究的分析中,在fNIRS坐标随机化后,迭代地(1000次迭代)重新计算了分区和fNIRS-ALE元分析。
元分析共激活和静息态功能连接
为了确定本研究的元分析结果在全脑功能背景下的作用,研究者使用元分析连接模型(MACM)在BrainMap数据上构建了一个共激活网络。由于MACM没有提供有关区域间连接强度的信息,因而本研究评估了MACM网络中的静息态功能连接(RSFC)模式。
功能情境化
为了探索观察到的激活模式的功能背景,研究者描述了与已建立的全脑静息态网络的关系,确定了本研究的INS发现与Neurosynth数据库中标记为功能域相关术语的生物行为域之间的关联,最后评估了与INS相关构建基础的元分析网络的关系。
生物情境化
然后,通过进行一系列全脑空间相关性分析来探索INS的神经生物学机制。简而言之,本研究首先评估了与神经递质图谱之间的关系,这些图谱通过空间相关分析进行量化,并对空间自相关和部分体积效应进行了校正。其次,基于从人类细胞标记基因获得的神经元细胞类型分布的空间关联验证了这些分析,使用神经成像特异性方法进行基因类别富集分析(GCEA)。为了评估这些分子和细胞水平系统在多大程度上可以解释INS,本研究使用了优势分析(dominance analysis,或称相对重要性分析),这种方法量化了每个预测因子对多元回归模型中总体解释方差的相对贡献。进一步的GCEAs是针对INS相关的发育基因表达模式,与精神病理学的关系以及INS相关的分子过程。
结果
文献检索和数据提取
通过检索大量INS相关术语,初步文献检索产生了2575条记录,其中79篇出版物符合元分析的条件(图2A为排除原因)。最终纳入了14篇fMRI超扫描出版物,8篇fMRI伪超扫描出版物,54篇fNIRS超扫描出版物和3篇fNIRS伪超扫描出版物(图2B)。INS焦点坐标从上述出版物中提取,或从fNIRS探针设置的手动重建中提取。
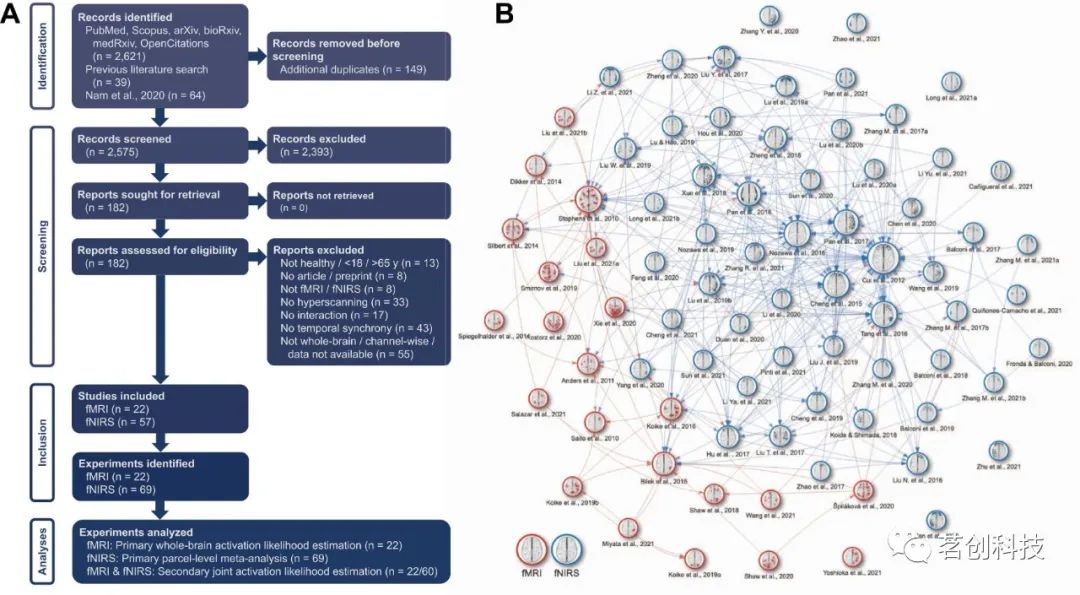
图2.结构化文献检索。
fMRI和fNIRS INS实验的空间元分析
为了确定与INS一致相关的大脑区域,本研究对符合条件的fMRI和fNIRS实验中报告的INS大脑坐标进行了单独的空间元分析。对于fMRI数据,本研究依赖于成熟的ALE方法,而对于fNIRS实验,本研究开发了一种与ALE方法相当的元分析程序。
①fMRI超扫描研究揭示了INS的稳健空间收敛性
ALE INS图显示大脑皮层分布主要集中在右侧顶叶-颞叶-岛叶区域。应用标准体素水平阈值(p<.001,未校正)后,在rTPJ和右侧STG中出现了两个具有显著空间收敛性的团簇。然后,采用更宽松的阈值(p<.01)时,观察到团簇大小增加,并且在右侧岛叶增加了一个簇(图3A)。敏感性分析证实了INS在rTPJ中的稳健空间收敛性,表明团簇在排除伪超扫描实验后仍然存在,在使用jackknife再抽样方法排除单个实验时是稳定的(图3A),并且对发表偏倚的潜在影响具有鲁棒性(fail-safe-N为66)。在这些分析中,右侧STG和岛叶的团簇并不稳定。
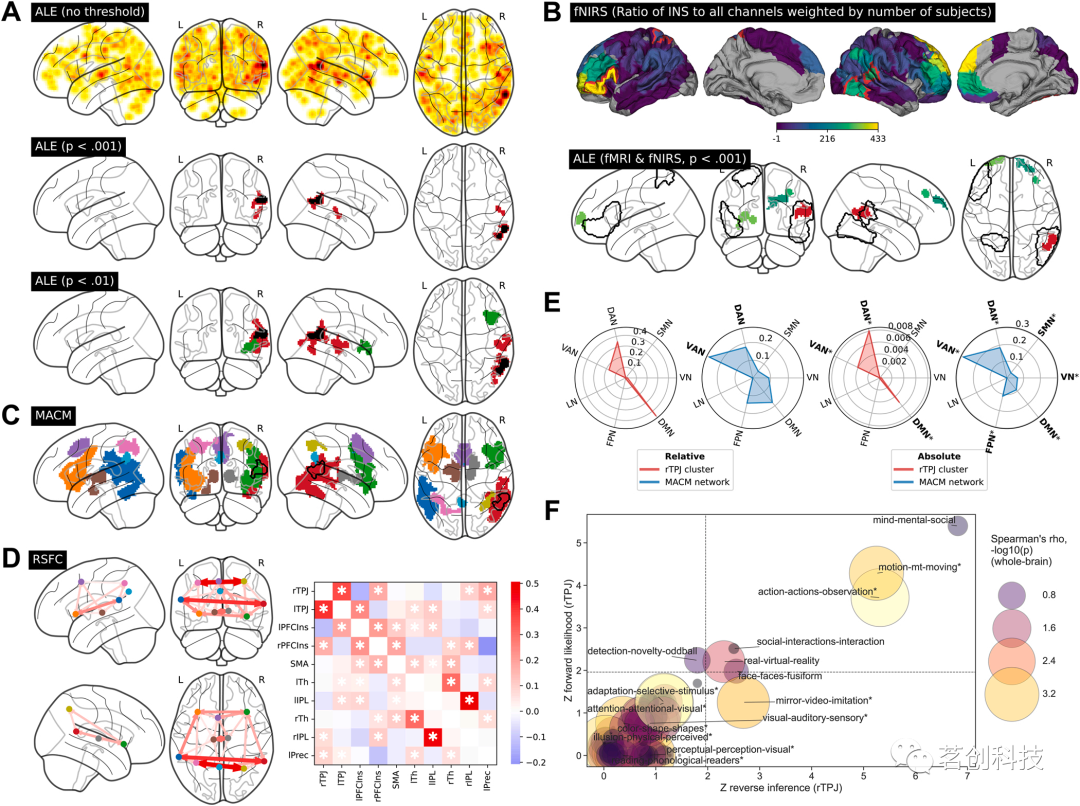
图3.由fMRI和fNIRS元分析得出的脑功能INS与其神经元连接和神经行为关联模式相关。
②fNIRS超扫描研究揭示的INS空间收敛性
fNIRS数据的元分析结果显示,右侧颞下回、左侧额下回和顶上回,以及右侧STG与fMRI衍生的rTPJ团簇存在重叠(图3B)。结合来自22个fMRI和60个fNIRS实验的INS坐标进行探索性ALE分析,结果显示有四个显著的簇,包括rTPJ、左腹侧额上回、以及右侧额中回和额上回(图3B)。fNIRS研究对前额叶团簇和rTPJ团簇均有贡献。由fNIRS数据得出的替代指标的评估进一步指向双侧前额叶和左侧颞顶叶脑区域。敏感性分析考虑了研究选择的偏倚和fNIRS数据的空间不确定性,显示了一般可比较的模式。然而,在fNIRS元分析中,左额上团簇的稳定性最高,而在fNIRS-fMRI联合元分析中,左额上团簇和rTPJ的稳定性最高。总之,与先前的研究结果和INS模型一致,本研究确定了rTPJ是一个稳定的、任务领域一般性的INS枢纽区域,并得到了fMRI和fNIRS数据的支持。fNIRS元分析还显示左下PFC区域参与了INS。
INS相关的神经元连接和生物行为关联模式
为了在大规模脑网络和生物行为域中建立已识别的INS枢纽区域的功能背景,本研究利用不同的开放神经成像数据库进行了一组大脑和任务功能关联分析(图1)。首先,从BrainMap数据库构建一个可能与rTPJ枢纽共同激活脑区的MACM网络,并评估了该网络中的RSFC模式。然后,为了探索观察到的激活模式的功能背景并辅助解释,本研究描述了与已建立的全脑静息态网络、Neurosynth数据库中的生物行为域,以及先前发表的INS相关结构(如社会互动、共情和ToM以及预测编码)的元分析网络的关系。最后,本研究评估了rTPJ团簇与rTPJ分区的关系。
①基于任务的共激活和静息态连接网络
148项BrainMap研究报告了rTPJ团簇内至少有一个激活焦点。元分析共激活网络主要涉及双侧额颞叶皮层区域,最大的团簇位于双侧TPJs、岛叶和背外侧PFC、辅助运动区和丘脑(图3C)。在该网络中,颞顶叶团簇之间的RSFC最强,而皮层下区域显示出主要与岛叶而非TPJs枢纽区域的功能连接(图3D)。另一项控制基线激活概率的分析也表明,TPJs是观察到的INS相关网络的唯一枢纽区域。比较INS-ALE图和MACM图的全脑模式,双侧TPJs、岛叶和背侧PFC在两个图中均显示出最高的激活可能性,表明MACM网络在INS中可能发挥了超越rTPJ激活的作用。根据区域间连接模式,rTPJ团簇及其相关共激活网络与默认模式和注意力静息态网络的空间关联最强(图3E)。
②INS相关网络的功能解码
本研究观察到rTPJ与ToM、行动、观察和社会互动相关的主题之间存在显著关联。在全脑水平上,与注意力和感觉领域相关的主题关联最强(图3F)。与此一致的是,INS相关的激活显示出与(情感)ToM和社会互动网络的总体一致性,并且与rTPJ后部亚单位的重叠相对较大,而后者本身之前与ToM和社会认知有关。虽然预测编码网络不包括rTPJ,但它与INS相关的MACM网络非常相似。总之,嵌入元分析INS的空间关联分析是在大规模脑网络环境下的结果,主要与注意、感觉和心智化过程有关。虽然TPJs再次作为枢纽区域出现,但我们不能排除INS也可能存在于主要涉及岛叶、PFC和丘脑等扩展的INS相关网络中。
INS与神经生理脑系统的关系
为了将元分析方法从宏观层面的脑区扩展到中、微观层面的神经生理功能,从而识别潜在INS的生物学过程,本研究进行了一系列全脑空间关联分析。首先通过神经递质图谱的空间相关性评估了INS和神经递质系统之间的关系。使用GCEA,确定了INS相关的神经元细胞类型,测试了INS与精神病理学之间潜在基因介导的关联,量化了神经发育过程中INS相关基因的区域富集,并确定了INS相关的分子过程。
①与神经递质系统和神经元细胞类型的空间关联
本研究观察到INS与GABA能(GABAA)和mGluR5受体的分布以及INS与突触密度(SV2a)之间存在显著的空间正相关。在没有FDR校正的情况下,INS进一步与5-羟色胺能(5-HT2A)和胆碱能成分(M1;图4A)相关。其余的神经递质图谱无显著相关。此外,GCEA表明与特定的兴奋性神经元类别Ex3,以及两类抑制性神经元In5和In6显著相关(图4B)。优势分析包括所有FDR校正的显著核成像和细胞类型图,显示总体解释方差为31.4%,其中Ex3的相对贡献最强(26.2%),其次是GABAA(19.8%)和mGluR5(18.5%)。

图4.INS与神经递质受体和突触密度分布的空间关联,以及神经元细胞类型、大脑发育和精神疾病的遗传标记。
②与发育基因表达、遗传疾病标志物和分子过程的空间关联
在29个类别中发现了显著的发育基因富集,揭示了一种(从出生后阶段就可以检测到,但)在成人皮层感觉脑区比较明显的基因表达模式(图4C)。值得注意的是,没有发现产前或皮层下区域的显著富集。此外,INS与神经发育障碍和继发性情感障碍相关的基因密切关联(分别为9/16和5/16;图4D)。最后,基于与INS分布空间相关的474个GO类别的语义聚类分析显示了与神经元和一般细胞发育以及神经元信号传递相关的过程。总之,本研究的结果指出了INS的神经生理学基础,主要包括参与感觉处理的抑制性和兴奋性神经元系统。与此相一致的是,INS相关基因①在出生后大脑发育开始时的皮层感觉脑区中表达最多,②并且先前有研究发现这些基因主要与神经发育障碍相关。
结论
近年来,大脑活动的同步已被认为是人类社会关系发展的重要机制,也是多种神经精神疾病发病的潜在因素。基于本研究的多模态数据融合方法产生的结果(见图5),假设人类INS与社会注意加工密切相关,rTPJ在大脑系统水平上作为感觉整合枢纽,并可能在神经生理水平上受GABA介导的E/I平衡促进。
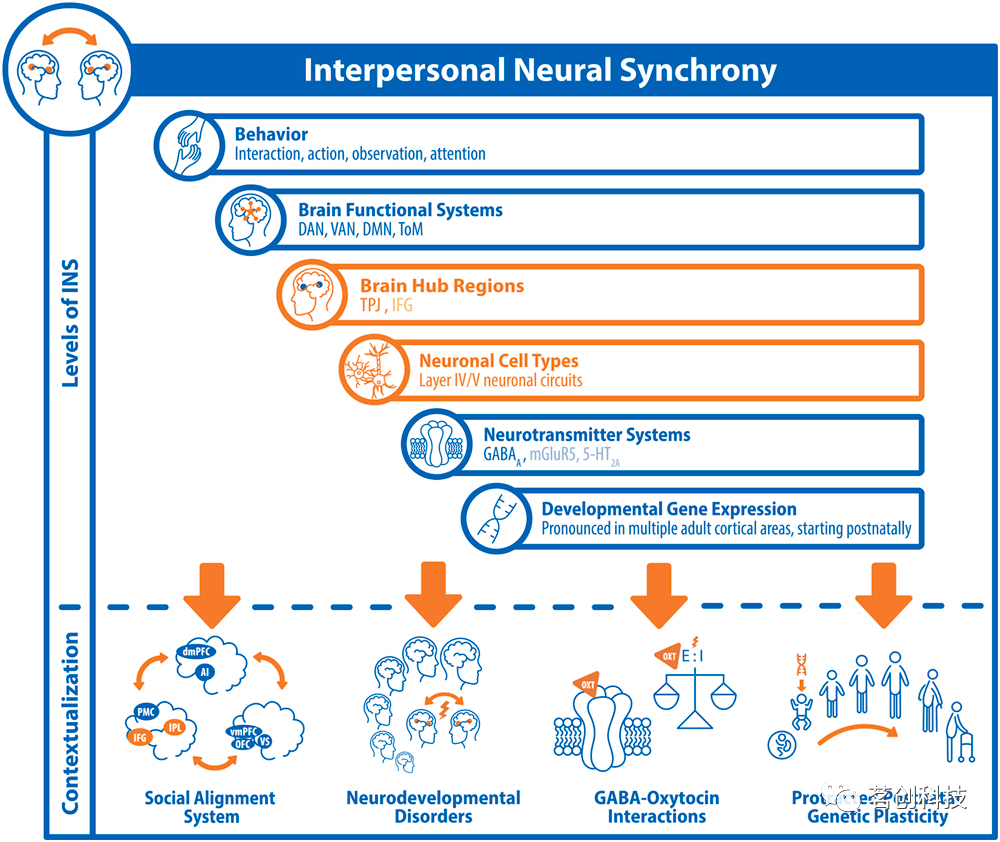
图5
本研究结果证实了rTPJ和左侧IFG在促进INS方面的核心作用。这两个区域都被认为是交互式社会注意系统的中心枢纽,被认为可以在互动的伙伴之间实现“耦合”。与许多群居物种一样,人类的个体间同步性放大了社会和谐和情感纽带,并且有意和自发地出现。我们的行为通过环境进行传播,我们大脑的感觉系统在神经元注意网络的支持下,有节奏地从环境中采样信息,并能够检测到这些行为。将一个人的行为与另一个人的感知同步,反之亦然,可能会导致大脑振荡的人际同步。rTPJ可以作为大脑处理注意信息的枢纽,并将这些信息整合到更广泛的环境中,与控制选择性注意、反应行为、精神状态推断和情感反应相关的大脑网络进行通信。在神经生理学上,这些人际同步振荡可能源于GABA介导的E/I平衡,接受来自丘脑传入的感觉输入。了解INS的工作原理也将有助于我们理解其机制是如何失效的,这可能对我们如何在个人和社会层面上看待和对待无序的社会互动产生重要影响。总而言之,本研究的方法证明了多模态关联分析的价值,不仅对精神病学研究,而且对推进典型发展人群的当前认知模型都非常有意义。研究者在设计这项研究时也考虑到了资源的再利用,为类似的未来研究/工作提供了一条途径。
原文:Revealing the Neurobiology Underlying Interpersonal Neural Synchronization with Multimodal Data Fusion.
https://doi.org/10.1016/j.neubiorev.2023.105042
这篇关于NBR最新:多模态数据融合下人际神经同步的神经生物学基础的文章就介绍到这儿,希望我们推荐的文章对编程师们有所帮助!







