本文主要是介绍Science Nature 双开花:改善过继性免疫细胞疗法的新手段 - MedChemExpress,希望对大家解决编程问题提供一定的参考价值,需要的开发者们随着小编来一起学习吧!
什么是过继性免疫细胞疗法?
过继性免疫细胞疗法 (Adoptive Cell Transfer Therapy, ACT) 是指将收集的患者的自己免疫细胞 (杀伤性 T 细胞),在体外培养改造后,使其靶向杀伤功能增强,再回输到患者体内,从而来消灭肿瘤细胞。过继性免疫细胞疗法可分为工程 T 细胞受体 (TCR) 治疗、嵌合抗原受体 (CAR) T 细胞治疗、自然杀伤细胞(NK)治疗和肿瘤浸润淋巴细胞 (TIL) 治疗。
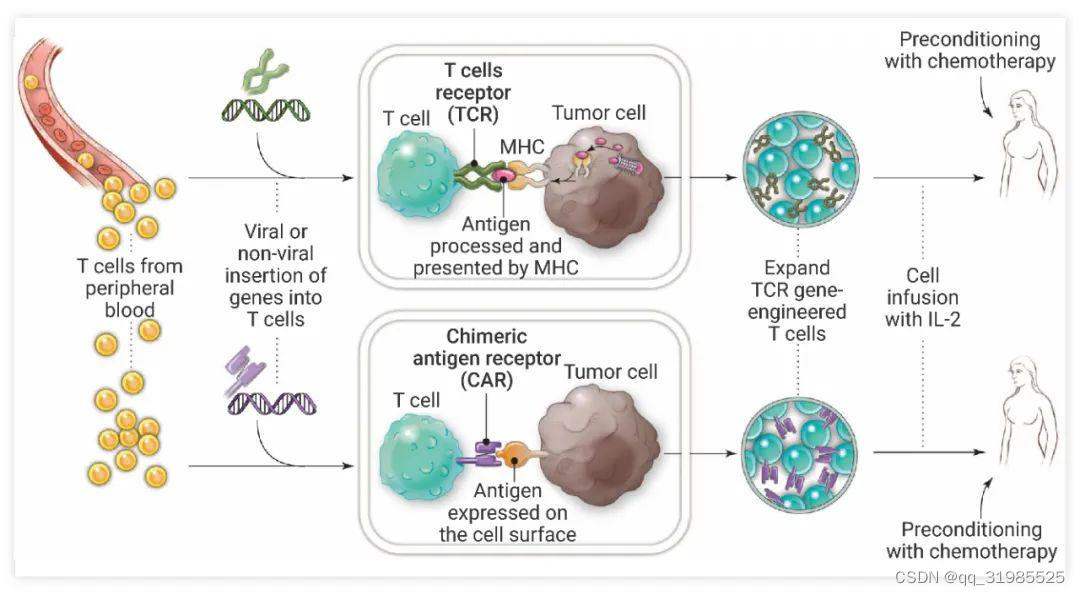
Fig. 1. 过继免疫疗法的 CAR-T 和 TCR 疗法[1]
CAR 技术:将人为设计的针对某种肿瘤相关抗原或者肿瘤特异性抗原单链抗体-CAR 通过基因工程方法引入 T 细胞表面重新定向 T 细胞的免疫反应
临床结果表明,ACT 疗法在血液瘤已经表现出优秀的成绩[2];但实体瘤异质性大,很少只表达一种肿瘤特异性抗原[7],并且瘤内免疫抑制检查点的信号的限制,ACT 疗法在实体瘤治疗中的使用还是有很大局限。
此外,过继性免疫细胞回输入体内后不久可能就逐渐死亡,无法在体内有效增殖,使得治疗持续时间较短。在接受过继性免疫细胞治疗之前要通过大剂量的化疗或放疗来清除体内免疫抑制细胞,以延长过继性免疫细胞在体内的生存时间。但大剂量化疗或放疗带来的副作用也非常明显,比如口腔炎、粘膜炎、腹泻、呕吐、脱发等[8]。 通过向患者体内输入共刺激因子 IL-2,诱导 T 细胞成为广谱杀伤性细胞,来改善 T 细胞的存活、功能和抗肿瘤活性,也是一种辅助治疗手段[1][3]。但是,IL-2 的作用多效且复杂,IL-2R 也不止只存在于杀伤性 T 细胞,由于缺乏选择性,直接输入 IL-2 可能会导致其他非杀伤 T 细胞的激活,如 IL-2 还可激活 Treg 细胞从而抑制免疫作用。输入高剂量 IL-2 会造成严重的毒性,比如毛细血管渗漏综合征,这可能是由血管内皮细胞驱动的[3]。
Orthogonal receptor 正交细胞因子受体是正常受体的一种突变形式,可选择性地结合突变的细胞因子,而不与正常的细胞因子结合。
orthogonal IL-2 的治疗潜力
2018 年在 Science 期刊发表的论文 “Selective targeting of engineered T cells using orthogonal IL-2 cytokine-receptor complexes”。研究人员同时改造 T 细胞的共刺激受体 IL-2R 和 IL-2,使得经过改造的 IL-2 只与改造过的 T 细胞 IL-2R 结合,而不与体内其他 T 细胞表面的 IL-2R 结合,从而避免产生毒副作用 (Fig.2a-b)。
研究人员首先通过点突变破坏 IL-2 和 IL-2Rβ 的结合 (IL-2Rβ 链是 IL-2 信号转导所必需的,可独立结合 IL-2) ,然后从中筛选出 2 个具有和改造 orthoIL-2R 结合功能的orthoIL-2 突变体 (1G12 和 3A10)。其中 1G12 既可以激活 ortho T细胞,也可以激活野生型 T 细胞 (效力显著低于野生型 IL-2)。3A10 可以激活 ortho T 细胞,而不激活野生型 T 细胞。
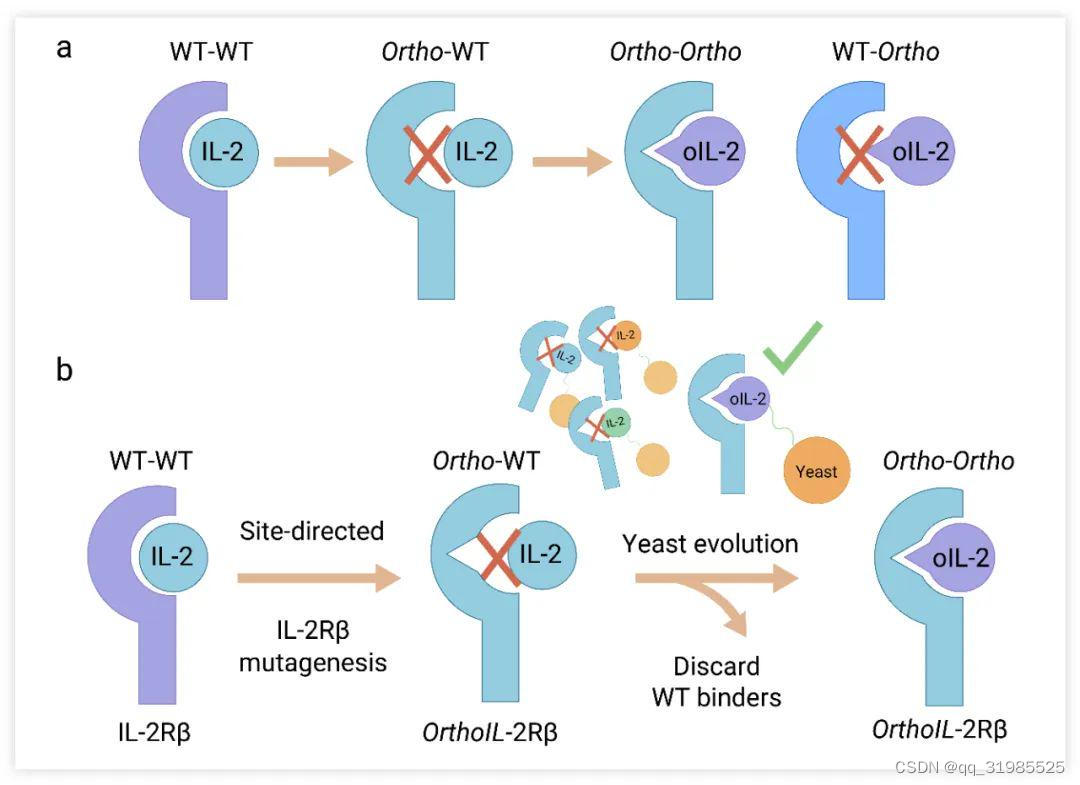
Fig. 2. 改造的 orthogonalIL-2 和 IL-2R 受体的设计[4]
随后,在过继转移模型中,研究人员将供体小鼠的野生型和 orthoIL-2Rβ 改造的 T 细胞 (Thy1.1+) 混合,过继转移至受体小鼠 (Thy1.2+) 体内。
在该模型中,注射野生型 IL-2 和 orthoIL-2 突变体后,IFNγ+ T 细胞均会增多,细胞杀伤力增强。但是野生型 IL-2 会上调具有抑制免疫杀伤作用的 PD-1 和 TIM-3 的表达,orthoIL-2 突变体则不会,这说明 orthoIL-2 突变体不抑制免疫杀伤作用 (Fig. 3a-3b)。此外,在黑色素瘤的动物模型中,过继转移 orthoIL-2Rβ Pmel-1 改造的 T 细胞和注射 orthoIL-2 突变体的小鼠肿瘤生长速度更慢,生存情况也得到了改善 (Fig. 3c-d)。这些结果证实了 orthoIL-2/IL-2 Rβ 具有良好的治疗作用。
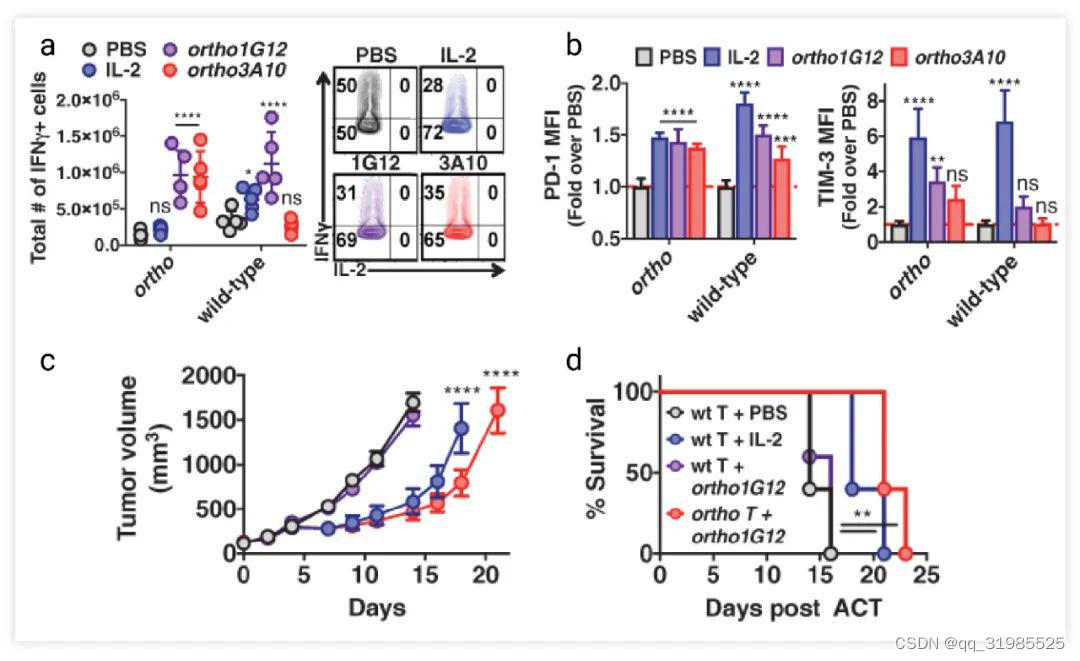
Fig. 3. orthoIL-2 突变体增强抗肿瘤反应[4]
a-b. 在 Fig. 2 的过继转移模型中,小鼠脾脏中 IFN-γ 阳性野生型或 orthoIL-2Rβ CD8+ T 细胞数量和细胞表面 PD-1 和 TIM-3 的表达水平。c-d. 荷瘤小鼠 (B16-F10 肿瘤) 在野生型或 orthoIL-2Rβ Pmel-1 改造的 CD8+ T 细胞和 IL-2 或 orthoIL-2 (1G12) 处理条件下肿瘤的体积变化和存活率
合成的 IL-9 受体强化过继免疫疗法 受此启发,研究人员又改造了其他来自 γc (细胞因子受体共同的 γ 链) 家族的细胞因子 (IL-2、IL-4、IL-7、IL-9 和 IL-21,共同调控免疫细胞的发育、增殖、存活和分化[4]) 的受体,2022 年,Anusha Kalbasi 教授团队在 Nature 发表了题为 “Potentiating adoptive cell therapy using synthetic IL-9 receptors” 的文章。通过使用嵌合的正交细胞因子受体重新利用 IL-9 受体信号,使 T 细胞获得了新的功能,从而提高了 T 细胞对难以治疗的实体肿瘤的抗肿瘤活性。
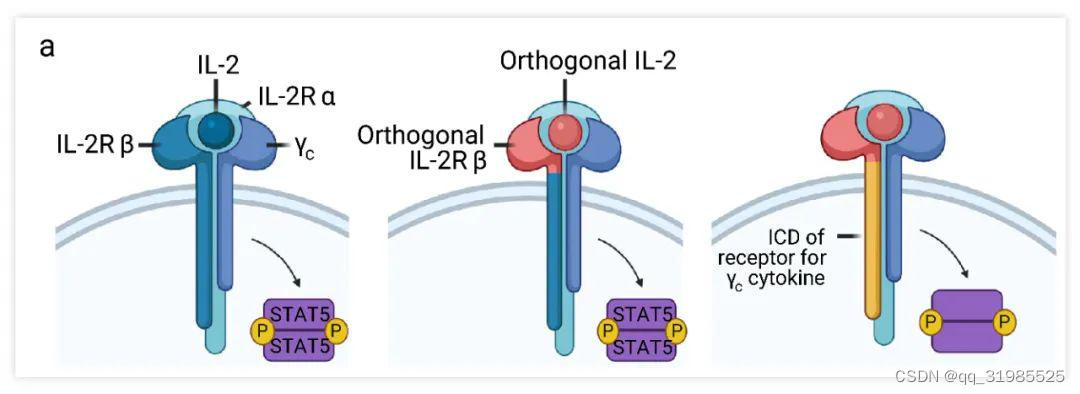
Fig. 4. 野生型 IL-2Rβ,改造的 orthoIL-2Rβ
或 γc 家族改造受体的示意图[5]
研究人员将 γc 家族细胞因子的受体 ICD 模块替换为 orthoIL-2Rβ 的 ICD 模块,改造出 o4R、o7R、o9R 和 o21R。用 MSA-IL-2 以及 MSA-oIL-2 刺激 T 细胞,发现 MSA-oIL-2 刺激 o9R 改造的 T 细胞引起了 STAT1、STAT3 和 STAT5 的明显磷酸化且 o9R 和 o21R 改造的 T 细胞高表达 CD62L+、Fas (CD95) 和 Sca-1,具有优越的抗肿瘤活性。
IL-9R 是 γc 家族细胞因子受体家族中研究较少的成员,与其他的 γc 链细胞因子不同,IL-9 信号在自然状态下的 T 细胞中通常不活跃[4]。研究人员推测 o9R 改造的 T 细胞可能具有治疗效果,并通过 “Pmel 模型” 来验证这一猜想 (Fig. 5a)。研究人员发现 MSA-oIL-2 处理的 o9R Pmel T 细胞在该模型中具有更好的抗肿瘤效果 (Fig. 5b-5c)。此外,MSA-IL-2的毒性作用在注射后 5 天后就可以观察到,而 MSA-oIL-2 没有明显毒性作用,荷瘤鼠存活率明显升高。研究人员还观察到在过继转移 5 天后,与 o2R Pmel T 细胞相比,o9R Pmel T 细胞浸润更大 (Fig. 5d)。除了改善肿瘤浸润,o9R Pmel T 细胞还具有更强的体外细胞杀伤能力。

Fig. 5. o9R 信号使 Pmel T 细胞在无淋巴耗竭的情况下具有抗肿瘤功效[5]。
a.Pmel 模型示意图。从小鼠脾脏中分离出 Pmel-1 T 细胞,分别改造为 o2R 和 o9R Pmel T 细胞,然后过继转移至黑色素瘤荷瘤鼠体内。荷瘤鼠接受辐照,或 MSA-IL-2 和 MSA-oIL-2 治疗 5 天。b-c. 肿瘤体积变化曲线和小鼠的存活率 。d. 与 o2R Pmel T细胞相比,o9R Pmel T 细胞浸润更大。
此外,研究人员还发现 MSA-oIL-2 导致 o2R 和 o9R Pmel 改造的 T 细胞的表型显著分化 (14 个簇中有 8 个差异明显) (Fig. 6a)。o9R Pmel T 细胞获得 TSCM 表型 (Sca-1, CD127, Fas 和 CD62L;在过继细胞治疗中以其优越的抗肿瘤活性而闻名的细胞亚群[6])。
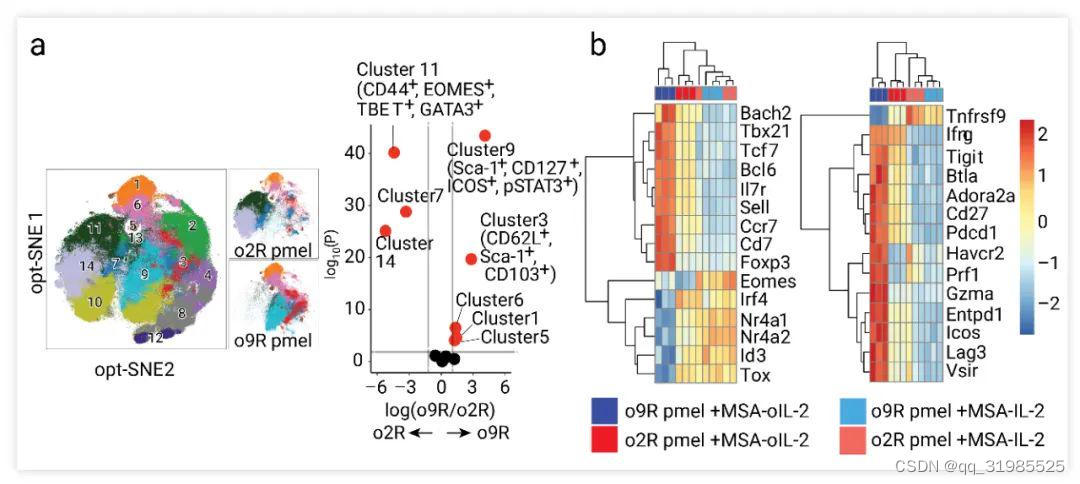
Fig. 6. MSA-oIL-2 使 o9R Pmel T 细胞获得 TSCM 表型[5]
a. MSA-oIL-2 (5 μM) 体外处理 o2R 和 o9R Pmel T 细胞 48h 后 opt-SNE 簇的分布。b. o2R 和 o9R Pmel T 细胞在 MSA-IL-2(50 nM) 或 MSA-oIL-2 (5 μM) 处理后基因表达的热图
研究人员还使用了一种具有免疫治疗抗性的胰腺癌模型 (PDA7940b,表达间皮素)验证这一体系在 CAR-T 治疗中的作用。 在胰腺癌动物模型 (PDA7940b) 中,单独使用 Ad-oIL-2 腺病毒载体或 CAR-o2R 或 CAR-o9R T 细胞治疗对控制肿瘤生长无效,然而,Ad-oIL-2+CAR-o2R T 细胞+化疗组 (67% 肿瘤完全消退) 或 Ad-oIL-2+CAR-o9R T 细胞+化疗组 (50% 肿瘤完全消退) 的联合治疗有明显抑瘤效果 (Fig. 7b)。在没有化疗组的情况下,Ad-oIL-2+CAR-o9R T 细胞抑瘤效果更加明显,肿瘤完全消退率为 42%。此外 CAR-o9R T 细胞在体外对胰腺癌细胞也显示出优越的抗肿瘤功效 (Fig. 7c)。CAR-o9R T 细胞的杀伤肿瘤效力更强。
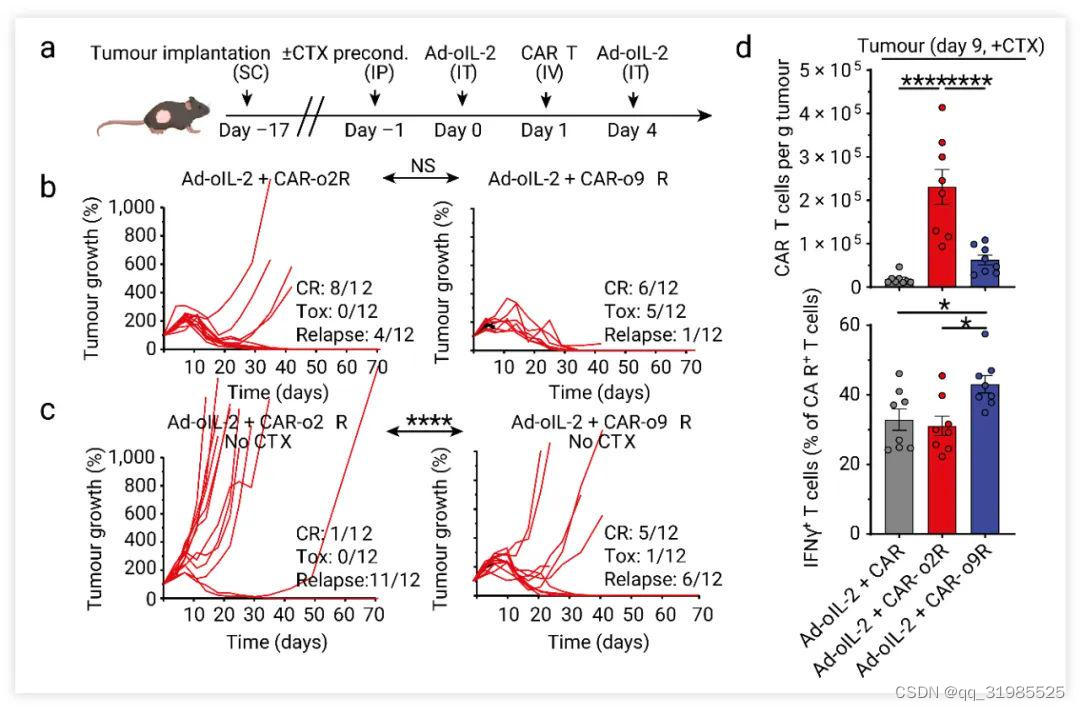
Fig. 7. o9R 信号通路提高了 CAR-T 细胞的效力[5]。a. PDA7940b 肿瘤过继转移治疗的模型示意图。b-c. 在 CTX 处理或没有CTX 处理的条件下 PDA7940b 肿瘤的个体生长曲线, CR:完全缓解;Tox:毒性;Relapse:复发。d. 在 CTX 治疗小鼠第 9 天是肿瘤浸润的 CAR-T 细胞的数量
总结:
研究人员通过改造的 IL-2 细胞因子—受体平台通过对 TCR-T 细胞和 CAR-T 细胞中的 o9R 信号进行特异性刺激,可提高T细胞的抗肿瘤活性,即使是在抗免疫治疗的顽固肿瘤模型或缺少化疗/放疗的严苛环境下仍保持优越的抑瘤活性。
相关产品 |
Ionomycin Ionomycin (SQ23377) 诱导蛋白激酶 C (PKC) 激活。 |
Cyclophosphamide Cyclophosphamide 是一种 DNA 烷化剂,具有抗肿瘤及免疫抑制活性。 |
Phorbol 12-myristate 13-acetate (PMA) Phorbol 12-myristate 13-acetate (PMA) 是一种佛波酯,是蛋白激酶 C (PKC) 和 SphK 的激活剂。 |
IL-2 Protein, Mouse (E. coli) IL-2 Protein, Mouse (E. coli) 是一种免疫调节细胞因子,具有促进淋巴细胞增殖存活的功能。 |
IL-4 Protein, Mouse (CHO) IL-4 Protein, Mouse (CHO) 来源于 CHO 细胞,促进 B 淋巴细胞的增殖,分化和细胞表面蛋白调节。 |
IL-7 Protein, Mouse (CHO) IL-4 Protein, Mouse (CHO) 来源于 CHO 细胞,促进 B 淋巴细胞的增殖,分化和细胞表面蛋白调节。 |
IL-9 Protein, Mouse (CHO) IL-9 Protein, Mouse (CHO) 来源于 CHO 细胞,TH2 细胞因子家族的成员。 |
IL-21 Protein, Mouse (129a.a) (E. coli) IL-21 Protein, Mouse (129a.a)可调节固有免疫和适应性免疫应答。 |
MCE 的所有产品仅用作科学研究或药证申报,我们不为任何个人用途提供产品和服务
参考文献
1. Rosenberg SA, Restifo NP. Adoptive cell transfer as personalized immunotherapy for human cancer. Science. 2015;348(6230):62-68.
2. Martinez M, Moon EK. CAR T Cells for Solid Tumors: New Strategies for Finding, Infiltrating, and Surviving in the Tumor Microenvironment. Front Immunol. 2019;10:128.
3. Poust, J. C., Woolery, J. E., & Green, M. R. (2013). Management of toxicities associated with high-dose interleukin-2 and biochemotherapy. Anti-Cancer Drugs, 24(1), 1–13.
4. Sockolosky JT, Trotta E, Parisi G, et al. Selective targeting of engineered T cells using orthogonal IL-2 cytokine-receptor complexes. Science. 2018;359(6379):1037-1042.
5. Kalbasi A, Siurala M, Su LL, et al. Potentiating adoptive cell therapy using synthetic IL-9 receptors. Nature. 2022;607(7918):360-365.
6. Leonard WJ, Lin JX, O'Shea JJ. The γc Family of Cytokines: Basic Biology to Therapeutic Ramifications. Immunity. 2019;50(4):832-850.
7. Krishna S, Lowery FJ, Copeland AR, et al. Stem-like CD8 T cells mediate response of adoptive cell immunotherapy against human cancer. Science. 2020;370(6522):1328-1334.
8. Hauner K, Maisch P, Retz M. Nebenwirkungen der Chemotherapie [Side effects of chemotherapy]. Urologe A. 2017 Apr;56(4):472-479. German.
这篇关于Science Nature 双开花:改善过继性免疫细胞疗法的新手段 - MedChemExpress的文章就介绍到这儿,希望我们推荐的文章对编程师们有所帮助!