本文主要是介绍脊髓神经回路功能障碍介导小鼠Dyt1-Tor1a肌张力障碍的病理生理学,希望对大家解决编程问题提供一定的参考价值,需要的开发者们随着小编来一起学习吧!
今天给同学们分享一篇实验文章“Pathophysiology of Dyt1- Tor1a dystonia in mice is mediated by spinal neural circuit dysfunction”,这篇文章发表在Sci Transl Med期刊上,影响因子为17.1。
结果解读:
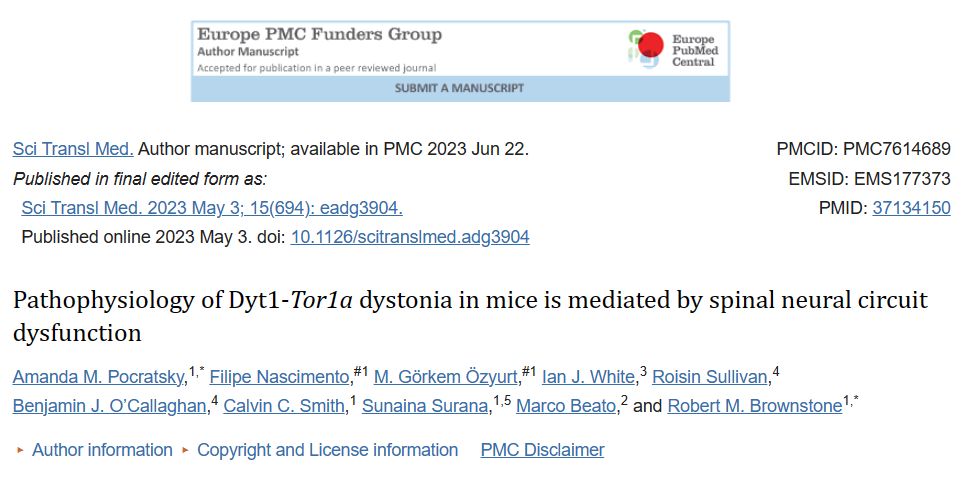
将Tor1a的删除限制在脊髓回路和背根神经节中
解开Dyt1-Tor1a型扭转痉挛中脊髓功能障碍对运动失调的具体贡献需要在Tor1a基因缺失中具有位点特异性:也就是说,脊髓回路必须直接受到影响,而上脑中枢则不受影响。为此,作者使用已建立的Cdx2::FlpO转基因小鼠模型作为作者在脊髓回路中操纵Tor1a的遗传入口,因为翻转酶表达仅限于发育中的脊髓和背根神经节(DRG)(25)。受到Tor1a-flox方法的启发(26-28),作者开发了一种新的Tor1a-frt小鼠,其中第3-5外显子被frt位点包围(图1A)。通过Tor1a-frt与Cdx2::FlpO小鼠的多代交配,作者生成了一个尾部限制的双等位基因“双重”条件敲除(d-cko)Tor1a。在大脑、腰椎脊髓和DRG中探测Tor1a和torsinA蛋白的表达确认了这种方法的位点特异性。与FlpO阴性的同胞对照组(Cdx2::wt;Tor1a frt/frt )相比,尾部限制的Tor1a d-cko(Cdx2::FlpO;Tor1a frt/frt )小鼠在大脑(以及心脏和肝脏)中显示正常的Tor1a-torsinA表达,但在腰椎脊髓和脊神经节中几乎没有表达(图1B-C),从而验证了作者策略的特异性。
托尔1a基因缺失的脊髓和背根神经节细胞的核膜病理学
作者接下来筛选了扭转蛋白A功能失调的超微结构特征,即核膜(NE)畸形。在神经元中,扭转蛋白A的典型表达分布在内质网和核膜中,但在功能丧失的突变中,扭转蛋白A异常积聚在核膜中(29)。形态学上,这可能导致外核膜突出,形成囊泡,然后释放到核周空间中(27, 30)。作者发现同胞对照的脊髓神经元具有正常、清晰、紧密相邻的核双层结构,偶尔有核浆网状物装饰核膜(图1D-F,J-K,箭头)。相比之下,删除了Tor1a基因的腰椎脊髓神经元充满了NE异常。在背角,有一些脊髓神经元看起来正常(图1G),表现出早期的NE萌芽迹象,伴有稀疏的囊泡积累(图1H),或者显示出囊泡堆积的核周空间,核膜明显分离(图1I)。相比之下,在腹角,几乎所有筛选的脊髓神经元都受到影响,核周空间充满了NE衍生的囊泡(图1L)。内核膜内的一个突起点通常会产生多个囊泡(图1M),囊泡内充满了电子致密的染色质物质,并被释放出来(图1N)。通过背散射扫描电子显微镜对所有相邻脊髓神经元进行大面积超微结构分析,证实了NE严重程度的腹背梯度。在L4-L5节段中筛查的2,711个脊髓神经元中,约60±6%显示出与torsinA功能丧失一致的超微结构异常。相比之下,在这些相同节段中筛查的DRG神经元中,受影响的神经元仅占8.0±5.0%,这表明脊髓神经元对Tor1a功能失调特别脆弱。此外,基底神经节神经元的超微结构筛查未显示出异常的NE突起或囊泡化。综上所述,这些数据证实了这个新的小鼠模型将Tor1a d-cko局限于脊髓和DRG神经元,脊髓神经元显示出torsinA功能丧失的超微结构迹象。因此,该模型将以脊髓Tor1a d-cko小鼠命名。
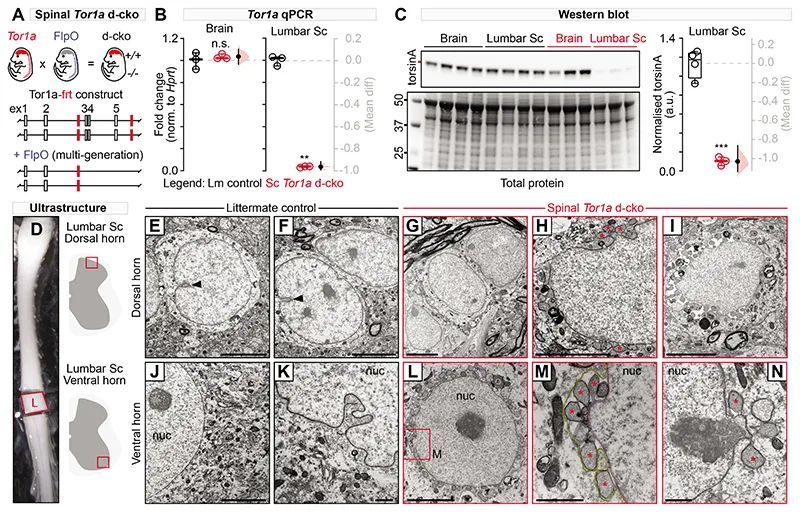
脊髓受限的Tor1a导致严重的早发性全身性痉挛
在人类中,严重的DYT1-TOR1A病症被定义为早期发病、普遍扩散的不协调运动,通常从下肢开始,然后扩散到躯干和上肢(32)。这些症状在颈部以下稳定,通常不影响头部肌肉功能(33)。作者发现人类严重DYT1-TOR1A病症的症状与脊髓Tor1a d-cko小鼠的症状相似(图2A-H)。脊髓Tor1a d-cko小鼠的运动障碍在出生后的头1-3天内早期出现,表现为尾巴后伸(图2A;视频S1)。这些症状在出生后第五天(P5)双侧扩散,影响到两个下肢(图2B)。随着年龄增长,运动障碍向前扩散,到了P7-P9时,出现了明显的骨盆、躯干和前肢功能障碍,前肢异常向前伸展,体重支撑减少(图2C-D)。到了P11,运动症状固定在头部以下,不影响口面部运动。步态受损,表现为过度的后肢后伸,屈曲减少(图2E)。尾悬吊期间出现后爪抓握和躯干扭转(图2F),这是一种常用于Dyt1-Tor1a扭转痉挛动物模型中的测试,用于发现潜在的类似扭转痉挛行为(34, 35)。到了P19-P21,脊髓Tor1a d-cko小鼠出现严重的扭转痉挛,姿势异常,肢体运动混乱(图2G),以及剧烈的躯干扭转(图2H)。与人类严重的DYT1-TOR1A相似,脊髓Tor1a d-cko小鼠的姿势异常,运动混乱、抽搐和颤动。
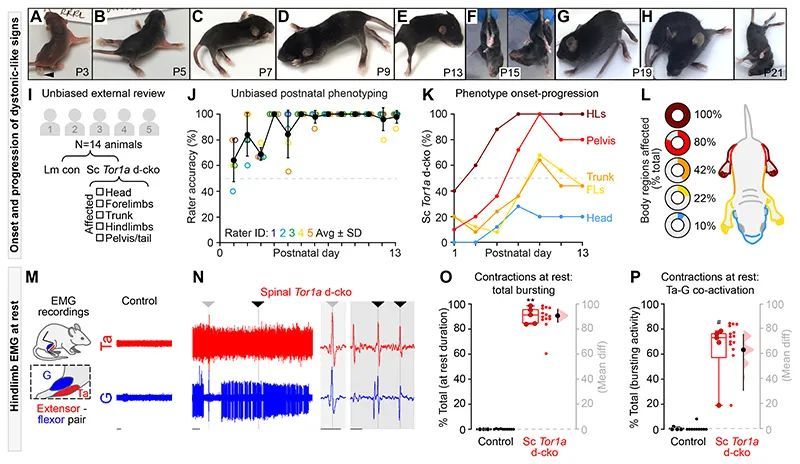
在脊髓中删除Tor1a的小鼠中存在过多、无组织的运动输出
作者接下来询问的是,Tor1a缺失的脊髓回路是否是过度自发活动和无序运动输出的主要来源。考虑到下肢是严重DYT1-TOR1A和脊髓Tor1a d-cko小鼠疾病发生的主要部位,作者对腰部扩大部分进行了针对性的神经活动记录 - 这是后肢运动控制的神经中枢(7)。腰髓从P1-P5小鼠中分离出来,从而消除了下行系统对脊髓运动输出的影响,并确定了先前定义的后肢功能障碍出现的时间窗口。将外部电极连接到尾端和头端的腰髓腹根,分别记录伸肌和屈肌相关的脊髓运动池的电神经图(ENG)活动(37)(图3A)。
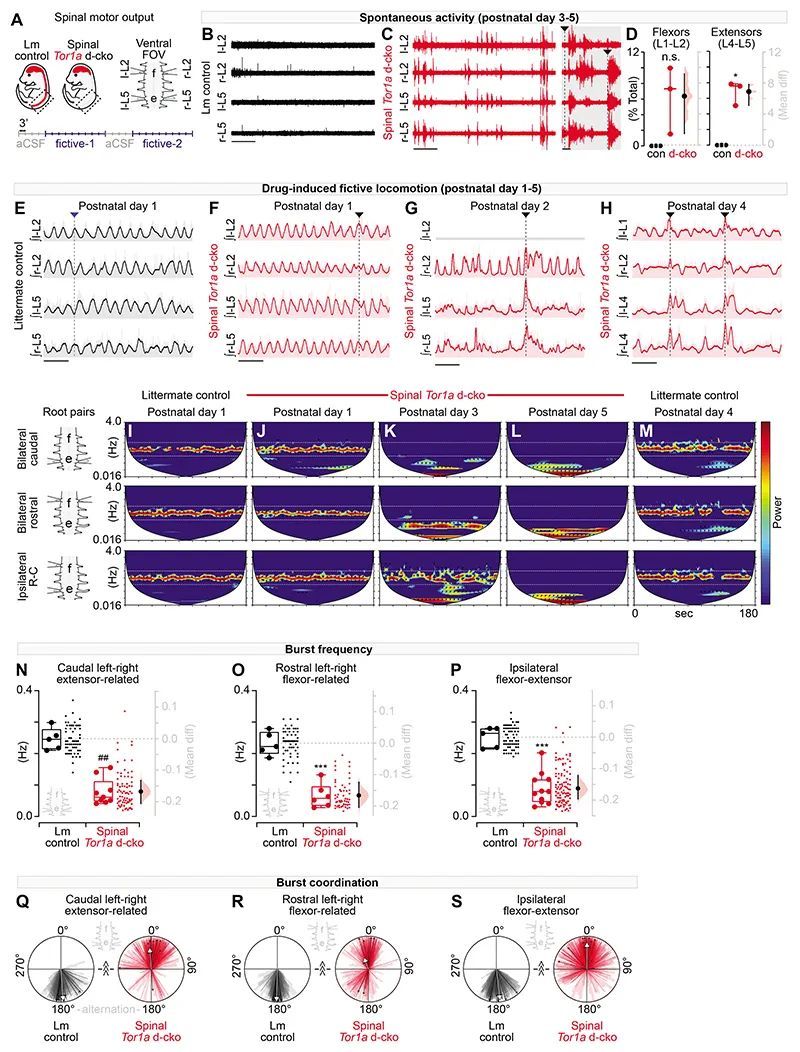
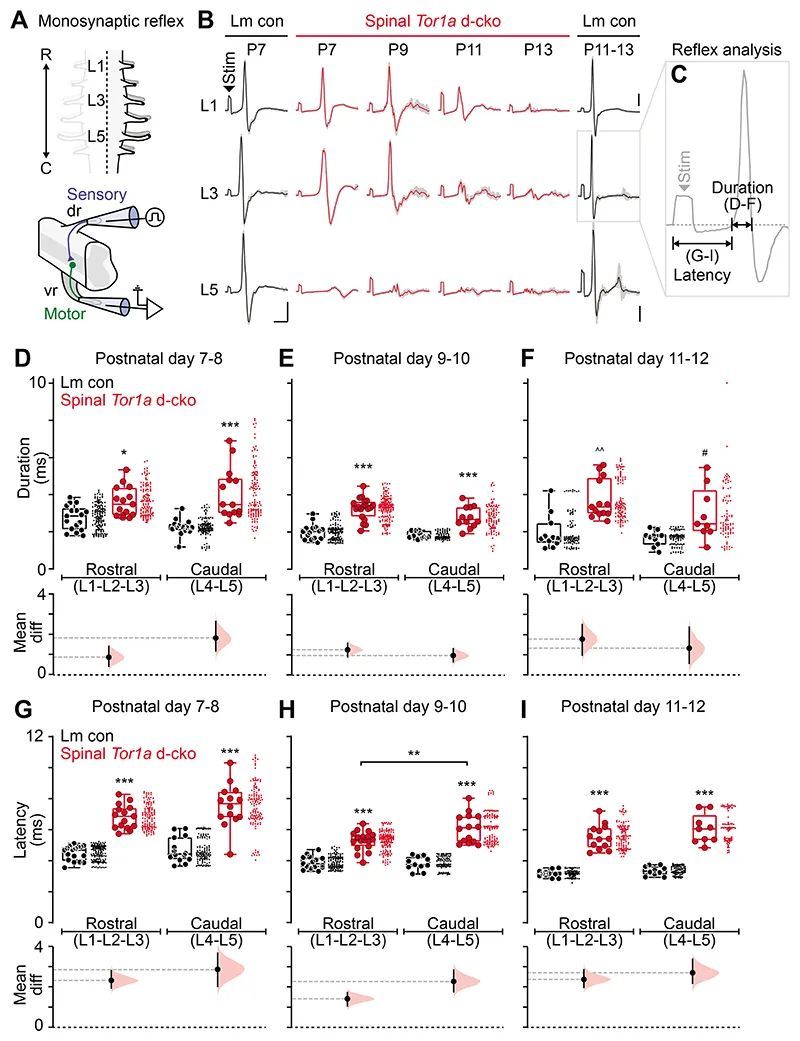
脊髓单突触反射在脊髓Tor1a条件性敲除中受损
鉴于脊髓运动神经回路功能障碍,作者接下来研究了最基本的脊髓回路,这也是可以在人类中容易研究的:单突触(肌腱反射)。病例报告表明,包括经基因确认的DYT1-TOR1A在内的广泛型肌张力障碍患者显示出单突触反射幅度减小(12, 40),诱发反应幅度变异增加(12, 13),以及异常异步活动的渗入(12)。因此,作者系统评估了脊髓Tor1a d-cko小鼠(L1-L5)在痉挛表型在后肢完全穿透的年龄范围内(P7-P13)的单突触反射。
对背根施加逐渐增强的刺激,并从腹根记录诱发的单突触反射(图4A,底部)。绘制代表性的单突触反射显示出与肌张力障碍样表型平行的时空模式。与同龄的同胎小鼠对照组相比,Tor1a d-cko小鼠的脊髓反射在P7时在最尾端的根部异常,但在最前端的根部(L1,L3)中三相波形似乎正常(图4B)。随着出生后的时间增长,单突触脊髓反射的损伤向前传播,影响到P11-P13时的L3和L1。对反射响应的组成部分进行检查(图4C)发现,脊髓限制性Tor1a d-cko小鼠的反射具有较低的振幅和较长的持续时间(图4D-F),并且具有多个异步峰值。除了这些反射波形的损伤外,与传入传导密切相关的起始潜伏期在所有段位和所有年龄的脊髓Tor1a d-cko小鼠中均比同胎小鼠对照组延长(图4G-I)。这些数据表明,在出生后的成熟过程中,单突触脊髓反射障碍存在明显的尾侧到头侧的进展,包括反射在时间上的分散。
脊髓Tor1a基因缺失导致单突触反射中的分布性病理生理学
作者接下来试图通过对这个反射弧的四个组成部分进行研究,以获得对反射功能障碍的机制洞察:(a)背根中的本体感觉传入神经元,(b)与运动神经元的突触连接,(c)运动神经元本身,以及(d)腹根中的传出传输。作者将重点放在尾端腰椎运动池(L4-L5),因为它们是最早受影响的部分。作者使用了一个腹角消融的准备(图5A)来确定运动神经元是否受到了脊髓限制性Tor1a缺失的内在影响。脊髓Tor1a d-cko小鼠中的运动神经元看起来比同胞对照组中的运动神经元要小(图5B)。虽然脊髓Tor1a d-cko小鼠中的运动神经元与对照组运动神经元具有相似的静息膜电位(图5C),但整体细胞电容减少(图5D),输入电阻增加了约350%(图5E),与细胞尺寸较小一致。综上所述,这些数据表明腰椎运动神经元直接受到Tor1a缺失的影响。

总结
总之,通过这种DYT1-TOR1A肌张力障碍模型,作者为研究该疾病的复杂病理生理学提供了一个新的切入点。肌张力障碍作为一种回路病,可以被认为是一个影响整个中枢神经系统运动回路的过程,包括脊髓中的运动回路。脊髓运动回路是大脑和肌肉之间简单的继电器的观点早已被打消。然而,在运动障碍的病理生理学中很少考虑脊髓回路功能障碍。作者认为,DYT1-TOR1a肌张力障碍的新治疗策略可能旨在解决潜在的病理生理症状,其回路主要存在于脊髓中。对这篇文章的思路感兴趣的老师,欢迎咨询!
这篇关于脊髓神经回路功能障碍介导小鼠Dyt1-Tor1a肌张力障碍的病理生理学的文章就介绍到这儿,希望我们推荐的文章对编程师们有所帮助!






