本文主要是介绍继“三级淋巴结”之后,再看看“单细胞”如何与AI结合【医学AI|顶刊速递|05-25】,希望对大家解决编程问题提供一定的参考价值,需要的开发者们随着小编来一起学习吧!
小罗碎碎念
24-05-25·文献速递
今天想和大家分享的是肿瘤治疗领域的另一个热点——单细胞技术,我们一起来看看,最新出炉的顶刊,是如何把AI与单细胞结合起来的。
另外,今天是周末,所以会有两篇文章——一篇文献速递,一篇文献精析(介绍哈佛医学院的那篇3D病理),感兴趣的同学可以看完这篇以后移步下一篇。

想看临床故事的,看第一、二、三、六篇文章,如果想找算法的,可以着重看看第四和第五篇文章,都是最新发表的,保证你能有收获。尤其是第四篇文章,居然用AI病理来研究胎盘,可能是因为我之前一直关注的都是肿瘤领域病理的应用,所以看到这篇文章的时候还是被小小的惊艳了一下。
希望今天的推文能对你有所启发,也希望小罗的文字,能给走在艰难科研道路上的你一丝慰藉。我们,明天见!!
交流群
欢迎大家来到【医学AI】交流群,本群设立的初衷是提供交流平台,方便大家后续课题合作。

一、破解胰腺癌之谜:三维基因组图谱揭示病变多发性与遗传异质性

文献概述
这篇文章是一项关于人类胰腺癌前病变(PanINs)的三维基因组图谱研究。
研究团队利用机器学习驱动的三维组织重建技术(CODA),对46个大体正常的人类胰腺组织样本进行了分析,以单细胞分辨率重建了三维组织结构。
研究发现,尽管PanINs体积小且在人体中难以接近,但它们是胰腺癌最常见的前体病变。
研究的主要发现包括:
- 人类胰腺中PanINs的数量、尺寸和连接性在以前是未知的,本研究通过三维分析揭示了这些特征。
- 平均每立方厘米胰腺组织中有13个PanINs,估算正常成人胰腺中存在数百个PanINs。
- 大多数PanINs作为独立的克隆体出现,具有不同的体细胞突变特征。
- 一些空间上连续的PanINs含有多种KRAS突变,表明它们具有多克隆起源。
- PanINs的广泛多发性和遗传异质性引发了关于驱动胰腺癌起始和差异性进展风险机制的重要问题。
这项研究提供了人类PanINs分子变化的详细三维基因组图谱,为胰腺癌的早期检测和合理干预提供了实证基础。研究还发现,KRAS基因的热点突变在PanINs中的分布与胰腺导管腺癌(PDAC)相似,表明KRAS突变在选择优势为PanINs发展提供关键优势的早期阶段就已发生。
此外,研究还利用了多区域目标和全外显子测序(WES)技术来评估PanINs内部和PanINs之间的遗传异质性。通过对多个区域的测序分析,研究揭示了PanINs在个体内部的复杂遗传起源,以及它们如何在空间上独立发展。
这项研究的局限性在于,所分析的大体正常组织可能并不代表真正的“正常”胰腺,且患者的年龄范围并不反映一般人群。尽管如此,这项研究为理解胰腺肿瘤发生的早期步骤提供了新的见解,并为未来关于PanINs多焦性和进展风险分层的研究奠定了基础。
重点关注
用于 CODA 3D 建模和测序的组织处理工作流程和队列

这个流程图分为几个部分,详细说明了如何从胰腺组织样本中创建三维模型,并进行后续的基因组测序分析。
顶部左侧:展示了胰腺组织样本的处理过程。每个胰腺组织块被连续切片,每隔两片就取一片进行染色(使用苏木精和伊红染色,即 H&E 染色),并进行成像,以便用于 3D 建模。
顶部右侧:介绍了 CODA(计算机辅助设计自动化)技术如何应用于这些连续切片的 H&E 染色图像。通过图像配准技术,将这些二维图像组合成一个数字体积,然后利用深度学习对不同的组织类型进行标记,这使得可以重建胰腺的微观结构的三维模型。
中间部分:说明了有38个组织块仅用于 3D 建模分析。这意味着这些样本只进行了成像和三维重建,没有进行进一步的基因组测序。
底部部分:描述了另外8个组织块的处理。这些样本不仅进行了 3D 建模,而且利用 3D 模型引导的多区域显微切割技术,对空间上不同的 PanINs(胰腺上皮内瘤变)进行显微切割。这些切割下来的组织样本随后用于下一代测序(NGS)和全外显子测序(WES),以分析它们的基因组变异。
总的来说,Fig. 1 展示了一个综合的多步骤工作流程,从组织样本的采集和处理,到利用先进的成像和计算技术进行三维重建,再到通过显微切割和基因组测序进行深入的分子分析。这个过程不仅提供了组织结构的详细视图,还允许研究人员探索这些结构在分子层面的变化,从而更深入地理解胰腺癌的发展。
二、打破肾癌免疫治疗的常规:低HLA特异性,高治疗效果?

文献概述
这篇文章是一项关于免疫疗法在治疗晚期透明细胞肾细胞癌(aRCC)中应用的研究。研究团队通过多组学映射和空间分析,发现了一种新的肿瘤转录组特征,即低HLA抗原肽结合特异性(HLAprLOW)的签名,该特征可以预测患者对免疫检查点阻断(ICB)治疗的临床反应。
研究包括对超过1000名患者的肿瘤转录组进行综合分析,并通过单细胞和空间分辨率进行验证。研究发现,与ICB治疗反应正相关的是肿瘤相关巨噬细胞(TAMs)和(前)耗竭的CD8+ T细胞之间的特定交叉作用,这种交叉作用通过具有更高偏好于肿瘤新抗原的人类白细胞抗原(HLA)谱来区分。
研究者们利用机器学习流程,从多组学数据中派生出一个新的肿瘤转录组足迹,用于预测HLAprLOW。这个机器学习签名与ICB治疗后的真实世界数据和独立临床队列中的积极结果相关联。此外,使用RENCA肿瘤小鼠模型的实验表明,CD40激动剂与PD1阻断相结合,可以增强促炎性肿瘤相关巨噬细胞和CD8+ T细胞,从而实现相对于其他测试方案的最大抗肿瘤效果。
因此,这项研究展示了一种新的多组学和空间图谱,该图谱推动了aRCC患者对ICB反应的免疫社区结构。这项工作不仅为预测ICB治疗的益处提供了新的生物标记,而且还为设计更有效的癌症免疫疗法提供了重要的见解。
重点关注
图1提供了关于晚期透明细胞肾细胞癌(aRCC)Leuven真实世界数据(RWD)队列研究的概览,以及免疫检查点阻断(ICB)治疗后患者结果的统计分析。
a部分:描述了研究的发现阶段,研究团队首先在aRCC的Leuven RWD队列中进行了研究,随后使用机器学习(ML)模型开发了一个签名。这个签名随后在外部(批量)数据集以及单细胞和空间层面上进行了验证,并且还在基因组层面进行了表征。最后,通过小鼠RCC/RENCA模型提供了体内功能性验证。
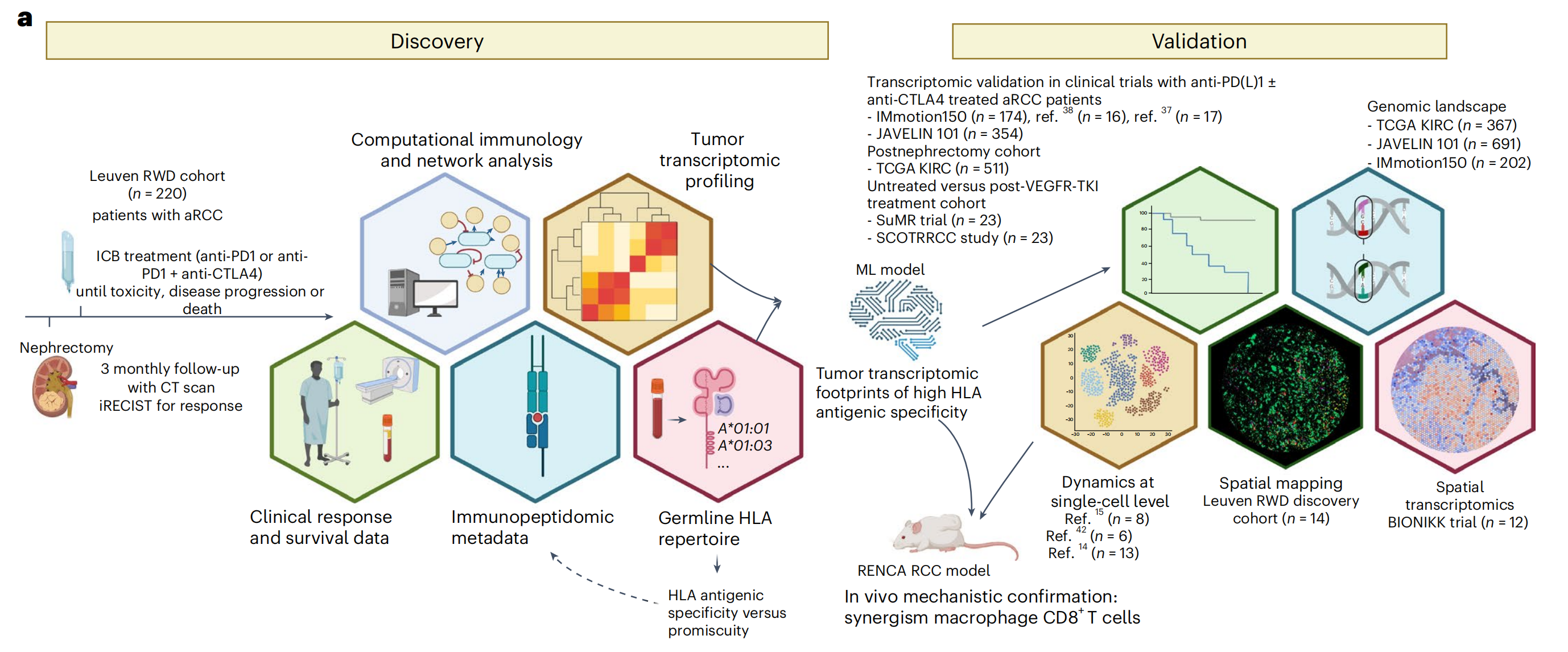
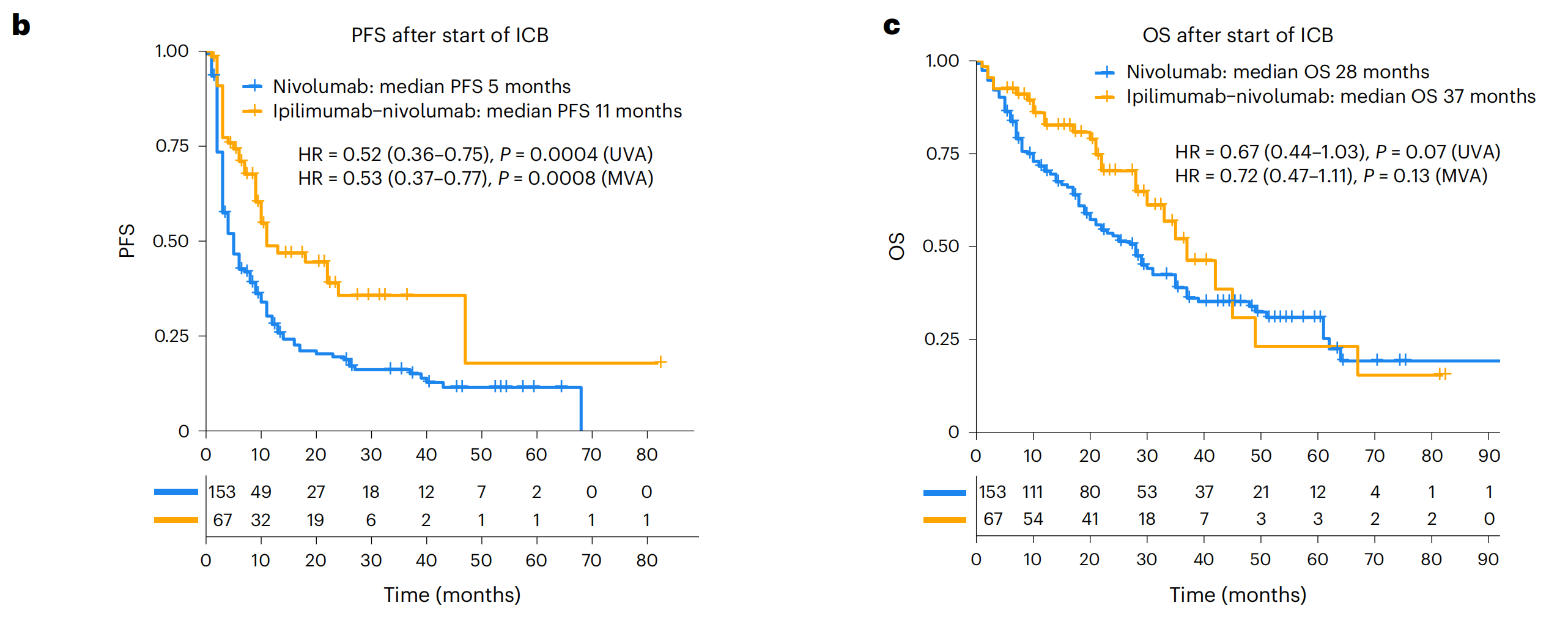
b部分和c部分:展示了Kaplan-Meier曲线,分别表示PFS(无进展生存期)和OS(总生存期)。这些曲线根据ICB治疗的类型对Leuven RWD队列的患者进行了分层。使用Cox比例风险回归模型计算了风险比(HR)和置信区间(CI),比较了接受伊普利姆玛布-纳武利尤单抗与单独纳武利尤单抗治疗的患者。同时展示了未调整(UVA)和多变量调整(MVA,调整了年龄和国际转移性RCC数据库联盟(IMDC)风险组)后的HR和双边P值。
d部分:是一个堆叠条形图,显示了ICB治疗(根据iRECIST标准)的最佳反应,包括完全反应(CR)、部分反应(PR)、稳定疾病(SD)、进展疾病(PD)和不可评估(NE)。使用Fisher精确检验计算了双边P值。
e部分:是瀑布图,展示了每位患者(根据iRECIST)的最大肿瘤收缩情况。CT指的是计算机断层扫描。

整体而言,图1提供了一个全面的视觉总结,展示了研究方法、治疗结果和统计分析,这些分析有助于理解ICB治疗在aRCC患者中的临床效果。
三、从静默到侵袭:揭秘乳腺导管原位癌的隐秘转变

文献概述
这篇文章是一篇关于乳腺导管原位癌(DCIS)向侵袭性乳腺癌(IDC)发展的综述。文章的主要内容包括:
-
DCIS的特征和临床意义:DCIS是乳腺癌的一种前期形式,表现为乳腺导管内上皮细胞的异常增殖。如果不治疗,25-60%的DCIS会发展成IDC。文章强调了区分非进展性和进展性DCIS的挑战,以及这对临床治疗的影响。
-
DCIS和IDC的分子特征:文章讨论了DCIS和IDC的分子亚型,包括激素受体阳性、HER2阳性和基底样亚型,并指出这些亚型与不同的肿瘤微环境和进化途径有关。
-
DCIS向IDC发展的分子机制:文章探讨了可能促进DCIS起始和进展的关键信号通路,如雌激素受体(ER)途径、HER2信号途径、PI3K/AKT/mTOR途径、MAPK途径和cyclin D1/CDK4/6/RB1途径。
-
DCIS和IDC的临床进展:讨论了DCIS和IDC的预后生物标志物和临床管理,包括手术、放疗、内分泌治疗和靶向治疗。
-
研究工具和模型:文章总结了用于研究DCIS的有价值的研究工具,包括体外和体内模型,以及新技术如单细胞测序、空间转录组学和人工智能。
-
DCIS的治疗策略:讨论了当前对DCIS的治疗策略,包括手术、放疗和内分泌治疗,并指出了治疗的争议性和过度治疗或治疗不足的问题。
-
DCIS的预后生物标志物:文章探讨了预测DCIS复发和进展的潜在生物标志物,如ER、HER2、COX-2、Ki67等,并讨论了Oncotype DX DCIS评分系统。
-
结论和展望:文章总结了DCIS研究的现状,并提出了未来研究的方向,包括深入理解DCIS的生物学特性、发展个性化治疗策略和改进风险分层系统。
文章强调了对DCIS更深入理解的重要性,以促进更有效的临床管理,并为未来的个性化治疗策略铺平道路。
重点关注
乳腺导管原位癌(DCIS)向侵袭性导管乳腺癌(IDC)进展的四种理论模型
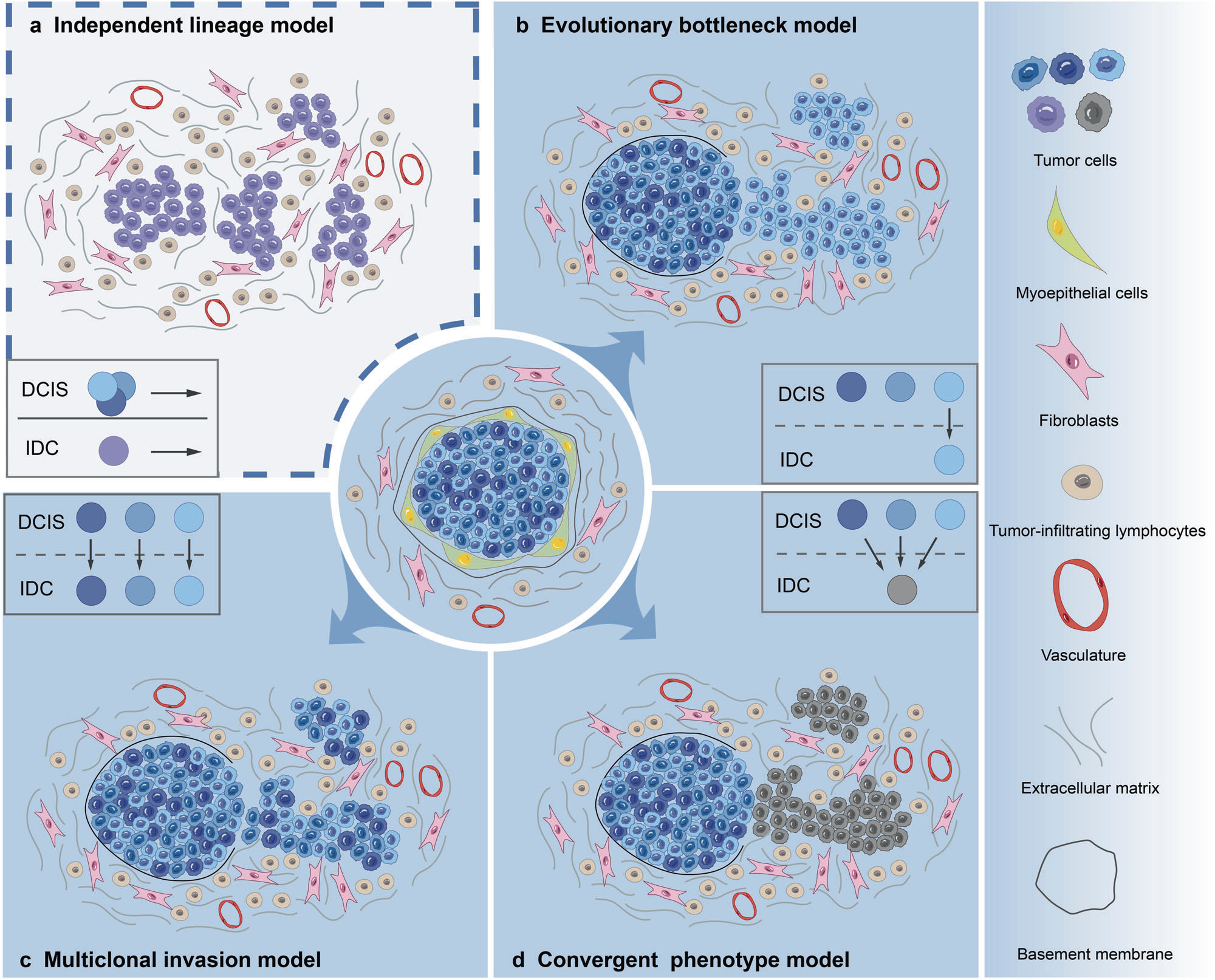
a. 独立谱系模型(Independent lineage model):
- 这个模型假设DCIS和IDC来自两个不同的正常上皮细胞,它们之间没有共享的拷贝数异常(CNAs)或突变。
- 这意味着DCIS和IDC是独立发展的,没有直接的谱系联系。
- 这个模型反对DCIS是IDC前体的普遍接受的观点。
b. 进化瓶颈模型(Evolutionary bottleneck model):
- 此模型认为在DCIS向IDC的转变过程中,只有具有特定遗传事件的一小部分DCIS肿瘤细胞被选择,并发展成单一克隆,随后突破进化瓶颈,演变成IDC。
- 这个模型强调了克隆选择的存在以及从DCIS到IDC转变过程中克隆多样性的减少。
c. 多克隆侵袭模型(Multiclonal invasion model):
- 与进化瓶颈模型不同,多克隆侵袭模型指的是多个亚克隆逃逸并共同迁移到侵袭区域,共同产生IDC。
- 这个模型提出了两种情况:一是多个亚克隆相互合作,甚至与肿瘤微环境(TME)合作;二是这些亚克隆具有不同的身份,可能被视为“领导者”和“追随者”亚克隆,一旦领导者亚克隆突破基底膜,追随者亚克隆就会加入它们。
- 这个模型认为DCIS-IDC转变是由多个癌细胞而非特定细胞群体决定的,并且受到非癌细胞因素(如TME变化)的影响。
d. 汇聚表型模型(Convergent phenotype model):
- 这个模型描述了DCIS内不同基因型的亚克隆可能都会产生侵袭表型,从而建立IDC,DCIS和相关IDC之间具有一致的基因组特征。
- 这表明具有不同基因型的肿瘤细胞可能经历潜在的相似或互补的变化,并最终获得相同的侵袭表型。
- 特别是,IDC的侵袭表型可能由DCIS中多种不同的基因组异常组合决定。
这些模型提供了不同的视角来解释DCIS如何进展为IDC,以及在这个过程中可能涉及的遗传和非遗传因素。它们也指出了未来研究的方向,特别是在理解肿瘤细胞内在特性和肿瘤微环境如何共同推动疾病进展方面。
四、AI赋能胎盘病理:攫取母婴健康的隐藏线索

文献概述
这篇文章介绍了一种名为HAPPY(Histology Analysis Pipeline.PY)的深度学习方法,它被开发用于量化分析人类胎盘组织学全切片图像中的细胞和微观解剖结构的变异性。
HAPPY方法与传统的基于图像块的特征或分割方法不同,它遵循可解释的生物学层次结构,能够在全切片图像中以单细胞分辨率表示组织内的细胞和细胞群。研究团队展示了一组来自健康足月胎盘的定量指标,作为未来评估胎盘健康的基线,并展示了这些指标在临床上显著的胎盘梗死中的偏离情况。
HAPPY能够模拟独立临床专家和胎盘生物学文献中的细胞和组织预测。该方法的开发是为了解决胎盘病理评估中的挑战,因为胎盘的异质性和时间变异性为组织学分析和病理变化的检测带来了困难。胎盘病理学对于管理母婴健康至关重要,能够为即时的临床治疗提供信息,预测后续妊娠中的复发风险以及母婴长期的不良结果,并解释妊娠丢失的潜在原因。
HAPPY通过三个阶段的深度学习管道工作:
- i) 用于
核定位的对象检测模型 - ii) 用于
细胞分类的图像分类模型 - iii) 用于
组织分类的图神经网络(GNN)
该方法能够处理任意形状或大小的输入图,使其能够应用于其他WSIs。HAPPY的代码库、训练数据和训练模型公开可用,支持最常用的WSI扫描仪格式,并提供了创建数据集和可视化输出的实用工具,以及培训和推理工作流程的教程。
此外,文章还讨论了HAPPY方法的泛化能力和领域转移问题,即模型对于未来数据的泛化能力必须对染色差异保持不变。研究者们通过数据增强和自定义的H&E染色增强,探索了核检测和细胞分类模型对染色不变性的影响。
最后,文章提出HAPPY方法为胎盘健康和病理过程的定量指标提取提供了基础,有望成为围产期病理学家和胎盘研究的宝贵数字组织病理学工具。
重点关注
Fig. 1 展示了 HAPPY(Histology Analysis Pipeline.PY)的工作流程,这是一个深度学习驱动的方法,用于分析人类胎盘组织学全切片图像(Whole Slide Images, WSIs)。
以下是对这一流程的分析:
-
图像分割:全切片图像首先被分割成重叠的小块图像,尺寸为1600×1200像素(对应物理尺寸为177.44×133.08微米)。这种分割允许模型处理图像的不同部分,同时重叠确保了边界区域的细胞也能被完整地检测到。
-
核定位:这些小块图像被输入到一个基于RetinaNet的对象检测模型中。RetinaNet是一个流行的深度学习模型,用于在图像中定位对象,这里它被用来识别图像中的细胞核。

其中,a. 绒毛板(chorionic plate)、b. 干绒毛和远端绒毛(stem and distal villi)、c. 远端绒毛(distal villi)、d. 基底板和锚定绒毛(basal plate and anchoring villi)。
- 细胞类型分类:每个被识别的细胞核为中心,进一步提取200×200像素(22.18×22.18微米)的图像块,这些图像块随后被一个ResNet-50模型分类为11种不同的细胞类型之一。ResNet-50是一个深度卷积神经网络,通常用于图像识别任务。

-
特征嵌入和空间图构建:细胞分类器产生的64维特征向量和细胞核的坐标被用来构建整个切片图像的细胞空间图。这个图表示了细胞的空间关系和它们的特征。
-
组织微结构分类:构建的细胞图被输入到一个ClusterGCN(Cluster Graph Convolutional Network)图神经网络中。ClusterGCN是一种专门设计用于处理图结构数据的深度学习模型,它能够对每个细胞所属的组织微结构进行分类。

总的来说,Fig. 1 描述了一个从图像预处理、细胞核检测、细胞类型分类,到细胞特征嵌入和最终组织微结构分类的完整流程。这个流程利用了深度学习技术来自动化和提高胎盘组织学分析的效率和准确性。
五、AnnoSpat工具:自动鉴定细胞类型并量化细胞间的邻近关系
文献概述
这篇文章介绍了一个名为AnnoSpat(Annotator and Spatial Pattern Finder)的新工具,它利用神经网络和点过程算法自动鉴定细胞类型并量化细胞间的邻近关系。该工具的开发是为了应对大规模空间蛋白质组数据集(如人类胰腺分析计划HPAP)中细胞类型注释和细胞相对位置量化的挑战。
AnnoSpat通过分析空间单细胞蛋白质组学数据(如图像质量细胞测量IMC和编码共检测CODEX)来实现其功能。它首先通过半监督聚类算法创建训练数据,然后训练一个分类器来预测额外细胞的身份。此外,AnnoSpat还配备了空间模式发现器模块,该模块采用点过程理论来量化多个细胞类型之间的空间关系。
研究人员通过基准测试评估了AnnoSpat在识别胰腺组织中各种细胞类型方面的准确性和效率,并将结果与其他方法进行了比较。测试结果表明,AnnoSpat在快速准确地注释细胞类型方面表现优于替代方法。
此外,AnnoSpat还被用于分析1型糖尿病患者、非糖尿病自身抗体阳性和非糖尿病器官捐献者的数据,能够重现已知的胰岛病理生物学,并展示了1型糖尿病进展期间胰多肽(PP)细胞丰度和CD8+ T细胞浸润的差异动态。
研究还探讨了AnnoSpat在新IMC样本中准确预测细胞类型的能力,并评估了其初始化对性能的影响。结果表明,AnnoSpat能够准确地预测具有特定抗体的新样本中的细胞类型。
此外,AnnoSpat还能够从CODEX数据中准确鉴定细胞类型,并与专家注释的胰腺组织中的细胞类型进行了比较,显示出较高的一致性。通过使用AnnoSpat的IMC分析,研究人员还观察到1型糖尿病进展过程中PP细胞数量的增加,以及在疾病早期阶段胰岛内CD8+ T细胞浸润的变化。
总之,AnnoSpat是一个强大的工具,可以用于空间单细胞蛋白质组数据的自动化分析,并能够准确地注释细胞类型和量化细胞间的空间关系。它的开发为理解复杂疾病(如1型糖尿病)的细胞微环境提供了新的视角,并有助于揭示疾病进展过程中的细胞相互作用和组织变化。
重点关注
Fig. 1 展示了使用 AnnoSpat(包括 Annotator 和 Spatial Pattern Finder 两个模块)分析 IMC(Image Mass Cytometry,图像质量细胞测量)或 CODEX(Co-Detection by Indexing,编码共检测)数据的流程概览。
以下是对该图的详细分析:
a. 单细胞蛋白质组学测量:
- 从左至右的流程开始于对组织感兴趣区域(ROI,例如来自胰腺的组织)的测量。
- 使用 IMC 或 CODEX 这类空间单细胞蛋白质组学检测方法,可以报告细胞的原位位置和蛋白质表达水平。
- 这一步骤依赖于细胞分割和通道强度的量化(见“方法”部分)。

b. 半监督聚类算法:
- 为了克服手动注释训练数据的缺乏,AnnoSpat 的 Annotator 模块首先使用半监督聚类算法处理蛋白质表达数据。
- 该算法从整体数据集中创建训练数据集(例如,矩阵 A 中的 50% 细胞)。
- 利用这个自动生成的训练数据,AnnoSpat 接着训练并应用一个极限学习机(Extreme Learning Machine, ELM)分类器,用于标记剩余的细胞(例如,矩阵 B 中的 50% 细胞)。

c. 空间模式发现器:
- AnnoSpat 的 Spatial Pattern Finder 组件将细胞位置解释为点过程,以量化细胞类型之间的关系。
- 它使用距离依赖的标记交叉相关函数(( k® ))来量化不同细胞类型之间的关系。
- 通过对 ROIs 中的标记交叉相关函数进行系统总结,使用它们不同的特征,例如函数最大的距离。
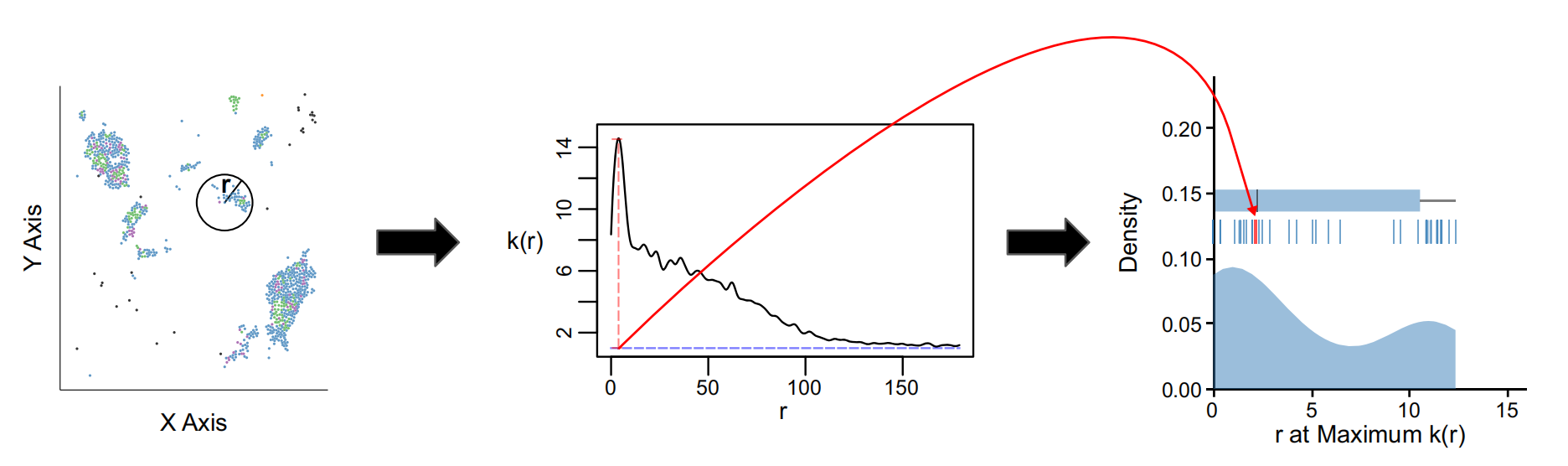
**总结:**Fig. 1 描述了 AnnoSpat 如何通过结合半监督学习和点过程理论,来克服空间蛋白质组数据中缺乏标注训练数据的问题,并实现对细胞类型的自动注释和空间关系的量化。这一流程不仅提高了细胞类型注释的效率,还增加了对细胞间复杂空间关系理解的深度。
六、肿瘤微环境新发现:肺癌细胞如何’策反’免疫卫士?

文献概述
这篇文章是一项关于非小细胞肺癌(non-small cell lung cancer, NSCLC)的单细胞和空间转录组学分析研究。
研究团队由Marco De Zuani、Haoliang Xue、Jun Sung Park等人组成,他们从25位未接受治疗的肺腺癌和鳞状细胞癌患者中收集了大约90万个细胞进行分析。研究发现肿瘤生态系统中存在多种免疫细胞类型,尤其是髓系细胞,在疾病进展中扮演重要角色。
研究结果揭示了抗炎性巨噬细胞与NK细胞/T细胞之间的负相关关系,以及肿瘤内NK细胞的细胞毒性降低。尽管肺腺癌和鳞状细胞癌在细胞类型组成上相似,但在多种免疫检查点抑制剂的共表达上存在显著差异。此外,研究还发现了肿瘤中巨噬细胞的转录“重编程”,使它们趋向胆固醇输出,并采取类似胎儿的转录特征,这有助于铁的外排。
这项多组学资源提供了肿瘤相关巨噬细胞的高分辨率分子图谱,增进了我们对其在肿瘤微环境中角色的理解。研究还发现肿瘤与邻近肺组织相比,具有更高多样性的免疫和非免疫细胞。在肿瘤中,成纤维细胞和淋巴内皮细胞的比例发生了变化,并且上皮细胞的多样性增加。
研究还探讨了肿瘤微环境中的细胞间相互作用网络,发现肺腺癌和鳞状细胞癌虽然在细胞组成上相似,但在细胞间相互作用网络上存在差异。例如,某些免疫检查点抑制剂及其相应的抑制分子在两种癌症中的共表达不同。研究还发现,在肿瘤微环境中,巨噬细胞亚群之间存在连续性,并且STAB1+巨噬细胞可能与肿瘤细胞紧密相关。
此外,研究还发现肿瘤巨噬细胞在肿瘤微环境中经历了“重编程”,采取了有利于胆固醇外排和铁外运的转录特征,从而支持肿瘤的进展。研究结果为开发针对NSCLC的更有效治疗策略提供了重要信息。
重点关注
Fig. 1 展示了非小细胞肺癌(NSCLC)异质性的单细胞转录组学分析结果。
以下是对图中各个部分的分析:
A. 研究概述:从切除的肿瘤组织、邻近未受累组织(背景)以及已故捐赠者的健康肺中制备了单细胞悬浮液,并富集了CD45+或CD235-的细胞进行单细胞RNA测序(scRNA-seq)。使用新鲜冷冻的肿瘤、背景和健康组织的冷冻切片进行10x Genomics Visium空间转录组学研究。
B. 队列概览:符号代表了个体患者以及执行的分析。
C. UMAP投影:展示了肿瘤和结合背景+健康数据集的UMAP(Uniform Manifold Approximation and Projection)投影图,这是一种用于降维和数据可视化的技术。

D. 点图(Dotplot):显示了用于肿瘤样本中宽泛细胞类型注释的代表性基因。点图通常用于展示基因表达水平,点的大小代表表达量,颜色代表表达水平的变化。
E. 等高线图(Contour plot):展示了在AT2细胞(44,399个细胞)、CAMLs(2520个细胞)和AIMφ(16,120个细胞)中共表达的髓系(LYZ, CD68, MRC1)和上皮系(EPCAM)基因。这些数据被标准化、缩放和对数转换。
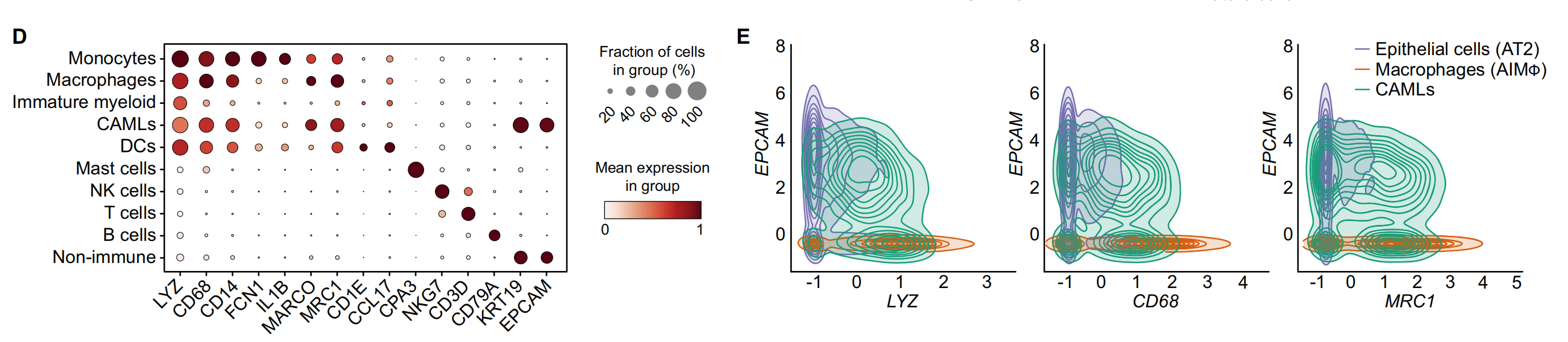
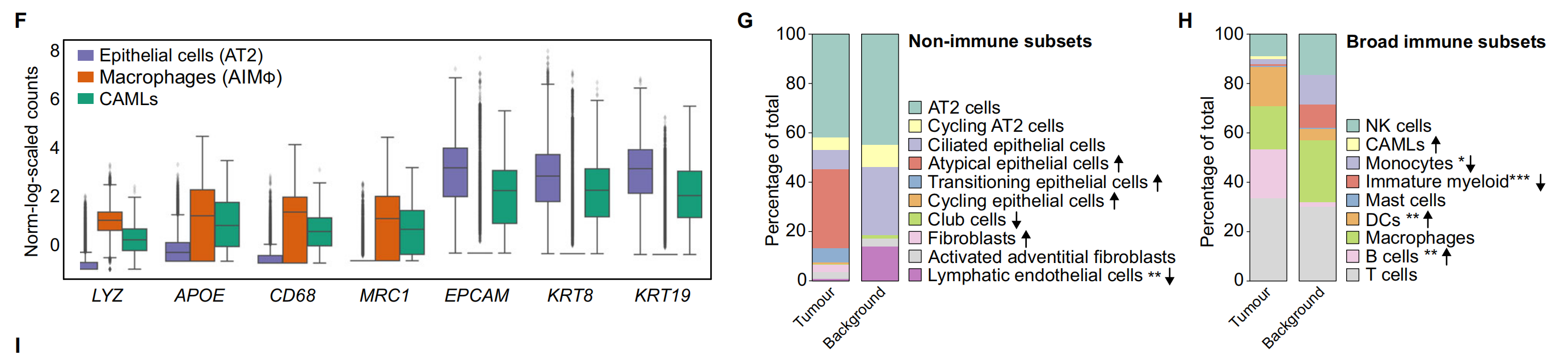
F. 箱线图(Boxplot):展示了在AT2细胞、CAMLs和AIMφ中髓系(LYZ, APOE, CD68, MRC1)和上皮系(EPCAM, KRT8, KRT19)基因的标准化、缩放和对数转换后的基因表达。箱形图显示了四分位数,须表示1.5倍四分位距。
G. 非免疫细胞亚群的相对比例:在CD235-富集中计算的肿瘤与背景之间的差异。箭头指示了肿瘤与背景相比的增加(↑)或减少(↓)。使用双边Wilcoxon秩和检验和Bonferroni校正进行多重比较。**P < 0.01。没有星号的箭头表示该细胞类型仅在肿瘤或背景中发现。
H. 广泛免疫细胞的相对比例:在所有免疫细胞中识别的CD235-富集中计算的肿瘤与背景之间的差异。箭头指示了肿瘤与背景相比的增加(↑)或减少(↓)。使用双边Wilcoxon秩和检验和Bonferroni校正进行多重比较。*P < 0.05, **P < 0.01, ***P < 0.001。没有星号的箭头表示该细胞类型仅在肿瘤或背景中发现。
I. 肿瘤和背景中NK、DC、B、T细胞和巨噬细胞亚群的相对比例:在CD235-富集中计算的广泛注释内的肿瘤与背景之间的差异。箭头指示了肿瘤与背景相比的增加(↑)或减少(↓)。使用双边Wilcoxon秩和检验和Bonferroni校正进行多重比较。***P < 0.001。没有星号的箭头表示该细胞类型仅在肿瘤或背景中发现。
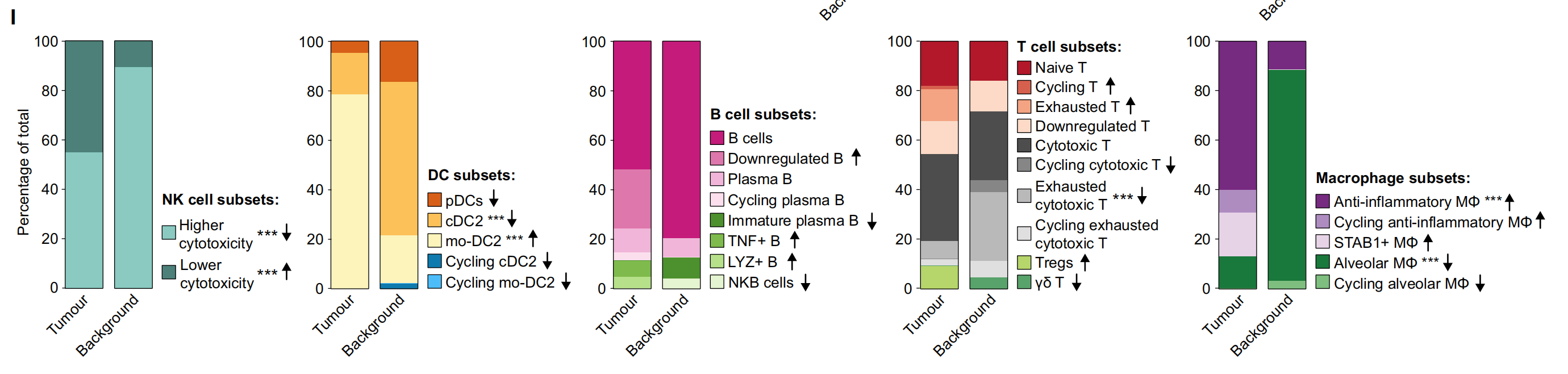
总体而言,Fig. 1 通过单细胞转录组学和空间转录组学技术,揭示了肿瘤组织与邻近正常组织在不同细胞类型上的异质性和差异。这些结果有助于深入理解肿瘤微环境中细胞的复杂性,并为未来的治疗策略提供潜在的靶点。
这篇关于继“三级淋巴结”之后,再看看“单细胞”如何与AI结合【医学AI|顶刊速递|05-25】的文章就介绍到这儿,希望我们推荐的文章对编程师们有所帮助!








