本文主要是介绍Cell长文:肿瘤研究中空间单细胞蛋白组技术如何提升10x 空转数据层次,希望对大家解决编程问题提供一定的参考价值,需要的开发者们随着小编来一起学习吧!
胶质瘤是高度异质性和浸润性的肿瘤,包含了不同细胞状态的恶性细胞。组织病理学发现了某些空间区域与局部组成结构相关,例如与缺氧相关的坏死灶。现在,技术的发展使我们能够重新审视经典组织病理学所捕获的空间结构,并通过对细胞类型和细胞状态的分析来进行定量描述。
前期的研究通过解离组织进行scRNA-seq已经定义了不同类型的胶质母细胞瘤(GBM)恶性细胞及不同的免疫细胞亚型,例如4种恶性细胞类型:neural progenitor-like (NPC),oligodendrocyte progenitor-like (OPC),astrocyte-like (AC)和mesenchymal-like (MES)。接下来就是在GBM微环境中对这些已定义的细胞进行原位空间分析。虽然一些研究利用了空间转录组Visium研究GBM,然而Visium并不能以单个细胞状态解决空间关系。因此,关于细胞状态和细胞类型如何相互关联以及与微环境的其他元素之间存在何种关系等,仍然存在许多悬而未决的问题。
为此,来自国外多家研究机构的科学家联合了10X Visium空间转录组和PCF空间单细胞蛋白组(PhenoCycler-Fusion,原CODEX)对GBM开展了全面和深度的空间原位分析。通过空间组学,研究者揭示了胶质母细胞瘤由无序区和结构化区组成。结构化区域包含了与缺氧相关的五个层次的组织结构。发现了经典组织病理学无法识别的区域特征。相关成果近期发表于Cell期刊,题名为“Integrative spatial analysis reveals a multi-layered organization of glioblastoma”。

01 研究设计
对13个GBM和6个IDH突变胶质瘤的组织切片进行10X Visium空间转录组分析。对12个相邻的GBM组织切片进行了40个抗体检测的PCF空间单细胞蛋白组分析。其中4个GBM样本中,获取了同一肿瘤内3种不同的组织块进行分析。并且此项研究的GBM Visium队列数据与外部的13个GBM Visium队列数据进行了合并分析(图1)。
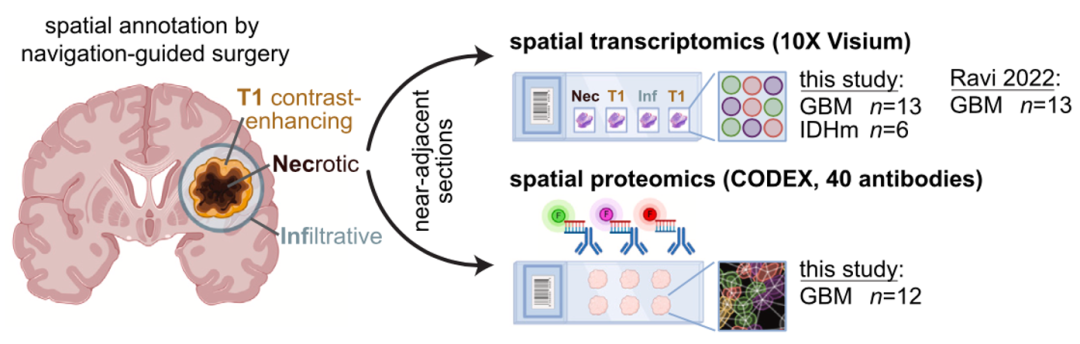
图1 研究设计方法
02 Visium分析空间基因表达特征
研究者分析了26个GBM Visium数据,总共提取了超过7万个spot的基因表达数据,对每个样本进行聚类成簇分析后,再通过跨样本间的整合分析将相似的簇聚成了一个metaprogram (MP)。结果鉴定了14个MP(图2):
1)8种恶性细胞类型:缺氧性的间质类型(MES-Hyp);间质类型(MES);神经祖细胞类型(NPC);星形胶质类型(AC);少突祖细胞类型(OPC);星形胶质样的间质类型(MES-Ast);增殖-代谢类型(Prolif-Metab);染色体调节类型(Chromatin-Reg);
2)6种非恶性细胞:巨噬细胞(Mac);炎症性Mac(inflammatory-Mac);少突胶质细胞(Oligo);血管细胞(Vasc);神经元(Neuron);反应性星形胶质细胞(Reactive-Ast)。
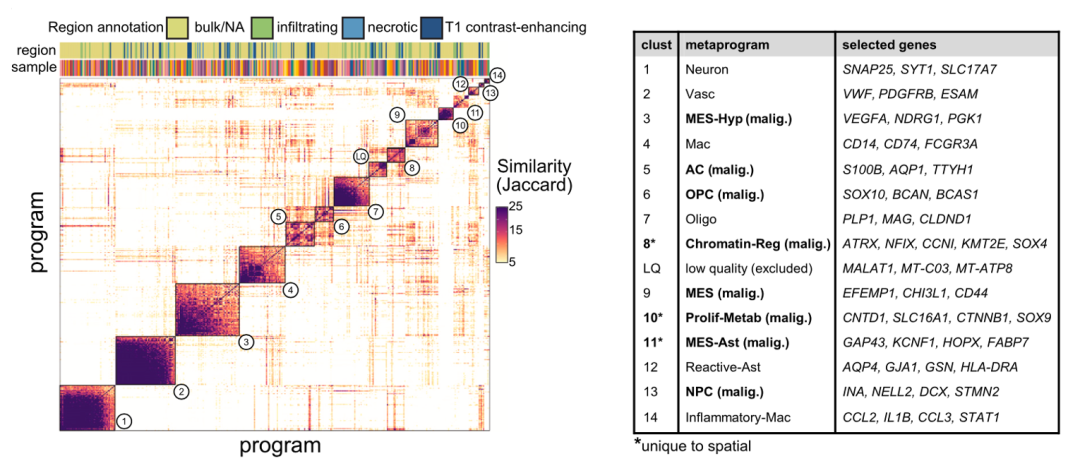
图2 Visium注释空间metaprogram
然而研究者指出了虽然Visium通过覆盖大多数基因提供了全面的数据,但它的空间分辨率较低,不适合捕获罕见或空间分散的细胞类型和细胞状态。例如,此项研究中他们并没有发现细胞周期相关的MP,这就提出了一种可能性:即在大多数情况下,一个处在周期活跃的细胞被很多其他类型的细胞所包围,从而稀释了细胞周期信号。同样,T细胞和B细胞很少在一个spot中占主导地位,它们的低mRNA含量进一步限制了它们的信号,因此研究者无法通过无监督分析识别T细胞或B细胞相关的MP。
03 PCF空间单细胞蛋白组解析单细胞分辨率下的空间细胞类型
为了解决以上问题,研究者采用了PCF空间单细胞蛋白组对12个相邻GBM组织切片进行了40个抗体的检测(图3)。诠释了6种恶性细胞和8种非恶性细胞,包括了占比较低的T细胞和B细胞。通过PCF空间单细胞蛋白组分析发现了T细胞在每个样本中平均占比只有0.4%。另外还发现了细胞周期活跃的增殖性细胞,包括Ki67+ OPC-like恶性细胞(10.8%)和Ki67+ 血管细胞(4.6%),说明了微血管增殖活跃,这也是GBM的典型特征。
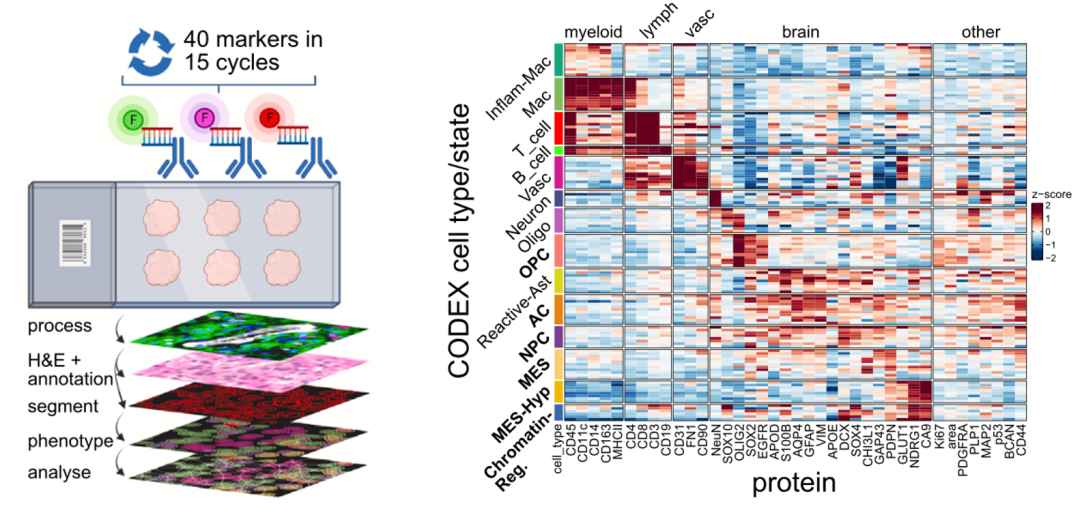
图3 PCF空间单细胞蛋白组分析GBM
04 整合Visium和PCF数据
研究者整合分析了PCF和Visium数据。在PCF样本上进行了虚拟的pseudospots构建。之后通过STalign方法将PCF和Visium样本进行了合并(图4)。结果是诠释了相对于Visium的每个spot中的细胞类型,同时将PCF呈现的单细胞分辨率下的空间细胞类型分配到了Visium定义的metaprogram中。即获得了高分辨率下的细胞类型关系以及对应的基因表达特征。
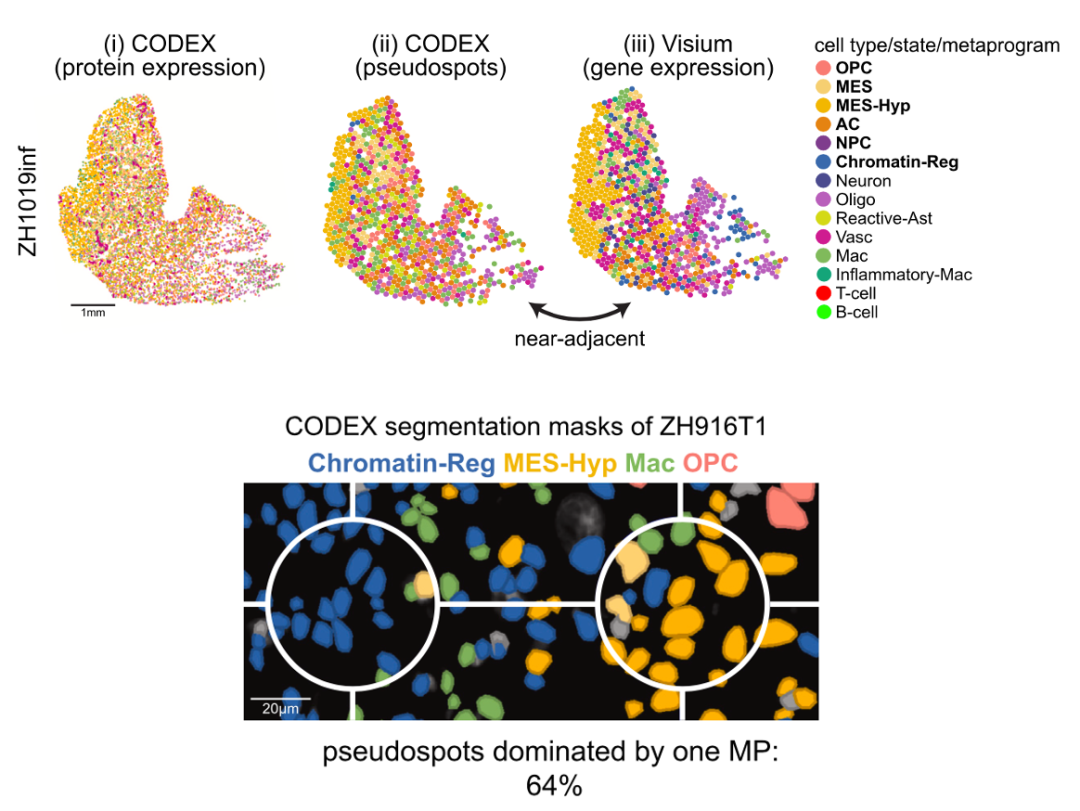
图4 Visium和PCF数据的整合分析
05 Visium联合PCF描绘GBM的空间结构特征
研究者分析了Visium定义的MP的邻近关系以及对应的PCF定义的细胞类型的邻近空间关系。通过分析同一个MP的邻近的MP数量,GBM组织空间可以分为结构化区域(structured)和无序区域(disorganized)(图5)。研究者进一步发现了结构化区域中占比最多的是缺氧性的恶性细胞(MES-Hyp),说明了缺氧是GBM有序结构组织的驱动因素。

图5 空间邻近关系诠释GBM的两种结构区域
接着研究者分析了不同区域大小和分辨率下的细胞类型的互作关系。发现了区域越大,结构化和无序两类区域中细胞互作的频率相似,但是在更低分辨率下,结构化的区域中细胞互作的频率显著高于无序的区域(图6)。例如在结构化的恶性细胞区域,巨噬细胞与MES-Hyp恶性细胞显著互作,而T细胞与MES-Ast恶性细胞显著互作。说明了结构化区域和无序区域在空间高分辨率下存在显著差异的细胞互作关系。
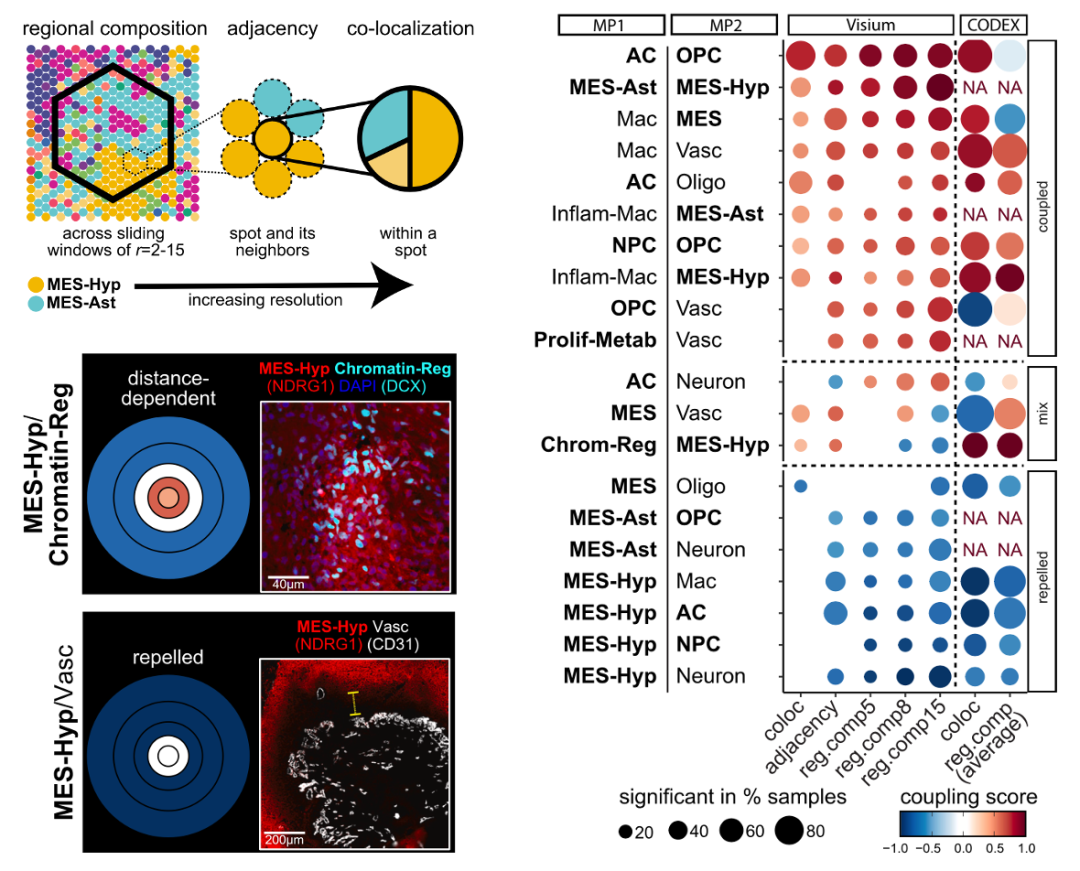
图6 不同空间范围内的细胞互作分析
06 空间组学揭示新的病理组织学特征
研究者整合分析了每个样本中上述的细胞互作关系,构建了结构化区域的样本的空间组成层次,发现了与缺氧相关的5个层次结构(图7),包括:
L1: core hypoxia/necrosis;L2: hypoxia-associated;L3: angiogenic response/immune hub;L4: malignant neurodevelopmental states;L5: brain parenchyma
每个层中都含有特征性的细胞类型及互作关系网络。特别是发现了其中的L1、L3、L4和L5可以对应到经典的组织病理学分类特征上。但是缺氧邻近层(L2)和小区域局部缺氧不能通过经典的组织病理学来区分,L2不能直接映射到组织病理学特征,因此空间单细胞分辨率上对细胞状态的分析重新定义了经典的组织病理学特征。
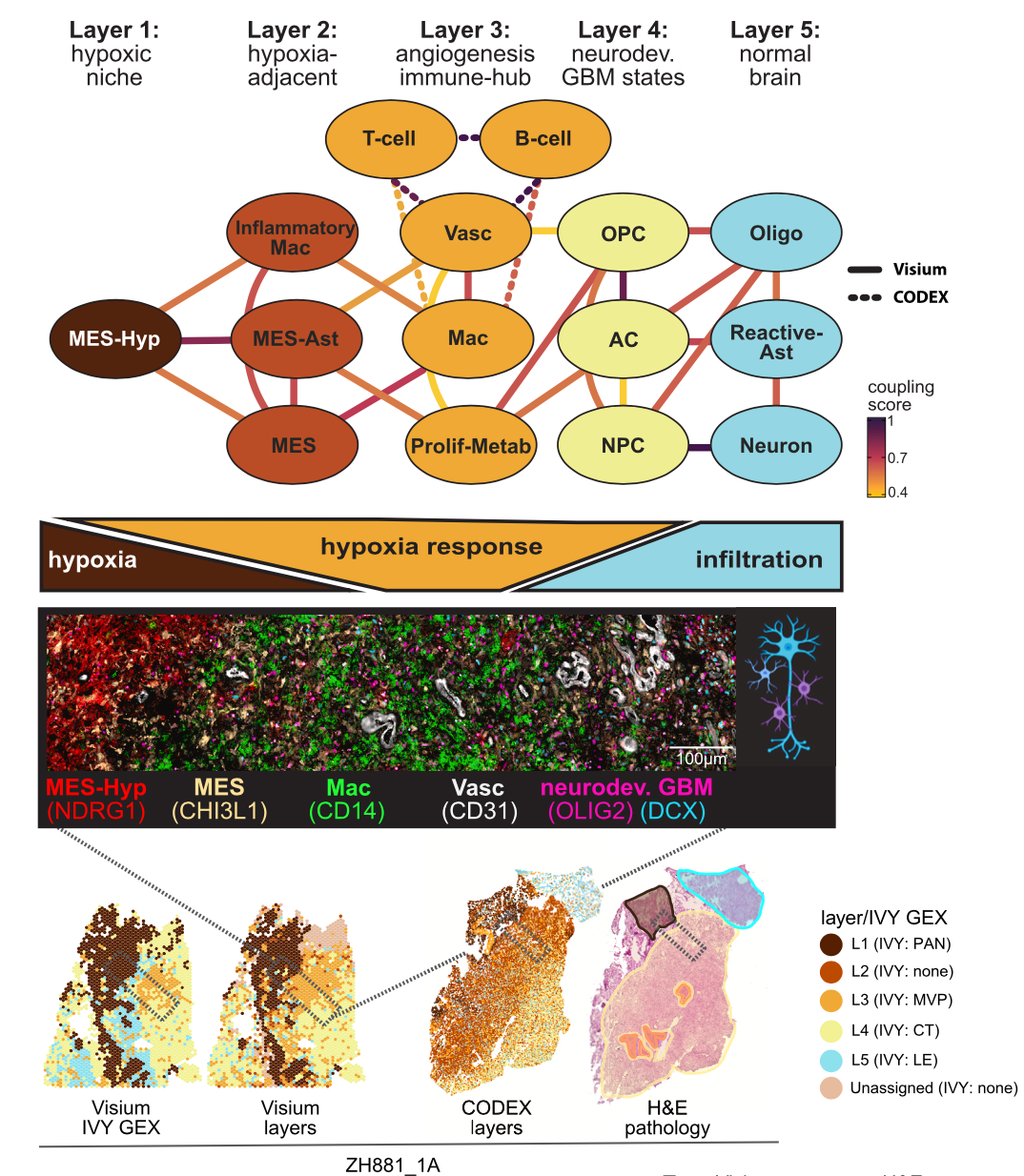
图7 GBM的5层组织结构
总结与讨论
此项研究结合空间转录组学、空间单细胞蛋白组学定义了胶质瘤细胞状态并揭示了它们的组织空间关系。由于Visium的分辨率有限,以前的研究只能定义空间社区,通常代表细胞状态和细胞类型的混合体,从空间转录组学中解析单个细胞状态和细胞类型仍然具有挑战性。为了弥补这些局限性,研究者对邻近的组织切片进行了PCF空间单细胞蛋白组分析,使研究者能够检测到低丰度的细胞类型,并以单细胞分辨率揭示Visium spot的组成。总之,这项研究对胶质瘤进行了深度的空间描述,在多个尺度上刻画了空间细胞组织,这为我们对胶质瘤微环境生态位的理解增加了一个空间维度,并可能有助于未来治疗方法的发展。
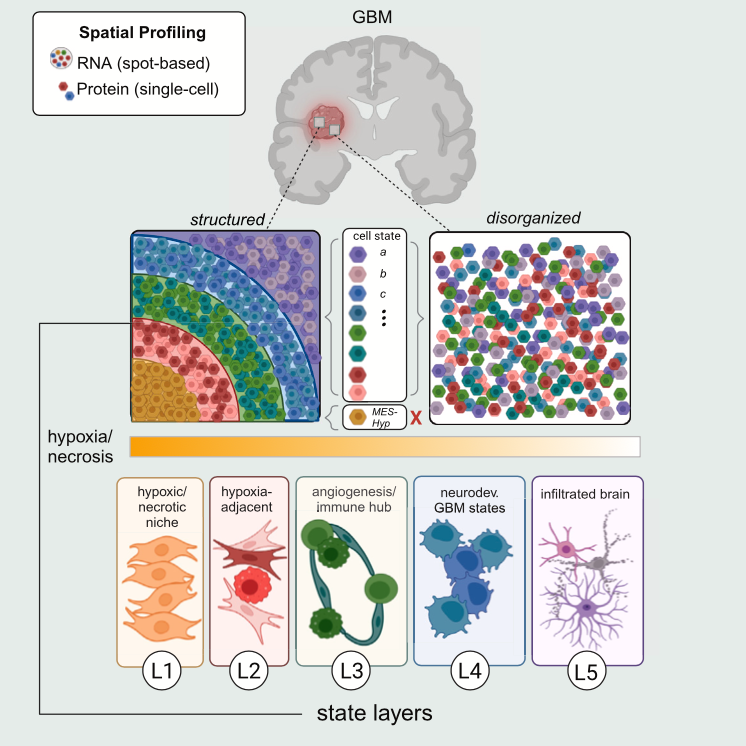
| PhenoCycler-Fusion单细胞原位空间蛋白组学优势

业务咨询400-869-2936或17316301592(微信同号)
相关文献
Greenwald AC, Darnell NG, Hoefflin R, Simkin D, Mount CW, Gonzalez Castro LN et al. Integrative spatial analysis reveals a multi-layered organization of glioblastoma. Cell. 2024:S0092-8674(24)00320-9.
![]()
1)先睹为快!2024 AACR年会:PCF空间单细胞蛋白组应用案例集锦
2)单细胞测序之后再怎么做?这篇文章告诉你答案
3)Immunity(IF=32.4)|空间多组学联合揭示免疫检查点联合疗法响应机制
4)真实数据!一张切片实现101种蛋白的超多重空间单细胞原位成像
5)炎症性肠病开启新的研究模式:从单细胞到空间原位分析
6)Cancer Research | 三级淋巴结构中的细胞亚型作为癌症复发的预测标志物
7)血液肿瘤进展|免疫细胞空间关系是细胞治疗应答的关键决定因素
8)Cancer Cell | PCF空间单细胞蛋白组鉴定三阴乳腺癌不同的治疗反应轨迹
9)PCF空间单细胞蛋白组发现免疫治疗反应关键的肿瘤微环境区域
10)Nature:PCF空间单细胞蛋白组构建肠道组织结构图谱
11)组织原位空间标志物:“PCF空单蛋“建立预测免疫治疗响应的新型空间评分系统
12)Cell:空间单细胞蛋白组学揭秘肝细胞癌中的细胞互作机制
| 工作邮箱:market@wayenbiotech.com
| 官网链接:www.wayenbio.com
这篇关于Cell长文:肿瘤研究中空间单细胞蛋白组技术如何提升10x 空转数据层次的文章就介绍到这儿,希望我们推荐的文章对编程师们有所帮助!





