本文主要是介绍病理组学+配对 mIHC 验证+转录组多组学,希望对大家解决编程问题提供一定的参考价值,需要的开发者们随着小编来一起学习吧!
目录
病理DeepRisk网络模型构建
DPS和新辅助化疗
mIHC 验证
STAD转录组层面
病理DeepRisk网络模型构建
自有数据训练,TCGA数据进行验证,然后配对mIF验证,最后还在转录组层面分析。
该模型基于中山数据集(n = 1120)构建,并在TCGA-STAD(n = 268)和SOBC数据集(n = 277)中得到进一步验证。

用于构建 DeepRisk 模型和评估 DPS 性能的工作流程。A 经过 WSI 的分割和修补过程,所有补丁都使用深度 CNN 模型编码为描述性特征表示。使用预训练的 ResNet50 模型提取特征图,并应用平均池化来获得特征向量。基于注意力的 MIL 用于聚合单个案例的所有补丁功能并提供输出标签。然后,我们构建了没有注释的 DeepRisk 网络,并在 2 个外部队列(TCGA-STAD 和 SOBC)中进一步验证。利用组织病理学特征、免疫质构、转录组学和临床信息来研究模型输出(DPS)与潜在GC特征之间的相关性。B 基于不同放大倍率下的DPS的C指数,有或没有纳入人口因素(年龄和性别)。C、D DPS在中山数据集中预测患者生存率的性能,使用一系列DPS临界值进行患者二分切。高DPS(>50%)和低DPS(≤50%)的OS和DFS的E,F Kaplan-Meier曲线。不同 TNM 阶段 DPS 生存和复发的 G、H Kaplan-Meier 曲线。p < 0.001。CNN,卷积神经网络;GC, 胃癌;WSI,全玻片图像;DPS,数字病理学特征;MIL,多实例学习;TCGA,癌症基因组图谱
DPS和新辅助化疗

为了调查具有不同 DPS 水平的 GC 是否对新辅助化疗 (NAC) 表现出不同的反应,我们的研究招募了 82 名接受 NAC 的 GC。如图所示。4A,与未接受NAC治疗的患者相比,接受NAC治疗后GCs的DPS水平显着降低。根据二宫和Ryan分类系统[25,26],我们观察到NAC治疗后的DPS水平与肿瘤消退分级(TRG)呈负相关(图1)。4我们对 NAC 治疗后 DPS 低的 GC 的分析显示,53.8% 的 GC 表现出更好的治疗反应 (TRG > 2/3) (图 1)。4C,D)。此外,在接受NAC治疗后,低DPS和高DPS患者之间存在显着差异(图1)。4因此,这些发现表明,NAC治疗后的DPS为GC患者提供了潜在的评估效果和预后价值,有助于后续治疗策略的优化。
mIHC 验证
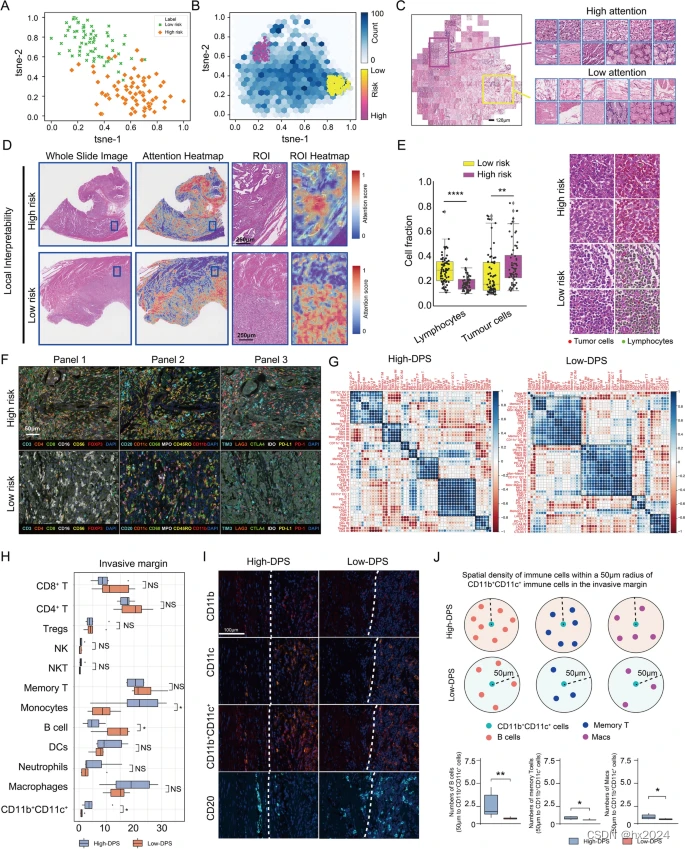
高DPS与侵袭性边缘的抑制性肿瘤免疫微环境相关。要素空间上高风险区域和低风险区域的可分离性。B–D 在热图上识别 DPS 高风险和低风险区域。E 低DPS组和高DPS组之间的淋巴细胞和肿瘤细胞的细胞分数。F mIHC 面板显示了高 DPS 和低 DPS 标本上 TIIC 的空间分布模式。G 相关矩阵,然后是高 DPS 组和低 DPS 组中 54 个免疫特征的无监督分层聚类。H 高DPS组和低DPS组之间侵袭边缘免疫细胞类型密度的差异。I CD11bCD11c免疫细胞和B细胞在侵袭边缘的mIHC表达模式。J 侵袭边缘 CD11bCD11c 免疫细胞半径 50 μm 范围内免疫细胞(记忆 T 细胞、B 细胞和 Mac)的空间密度。Macs,巨噬细胞。TIIC,肿瘤浸润免疫细胞。*p < 0.05,**p < 0.01,****p < 0.0001。数据表示为平均值± SEM。 **p < 0.01,****p < 0.0001。P, 瘤周组织;IM,侵入性切缘;T, 肿瘤核心++++
STAD转录组层面
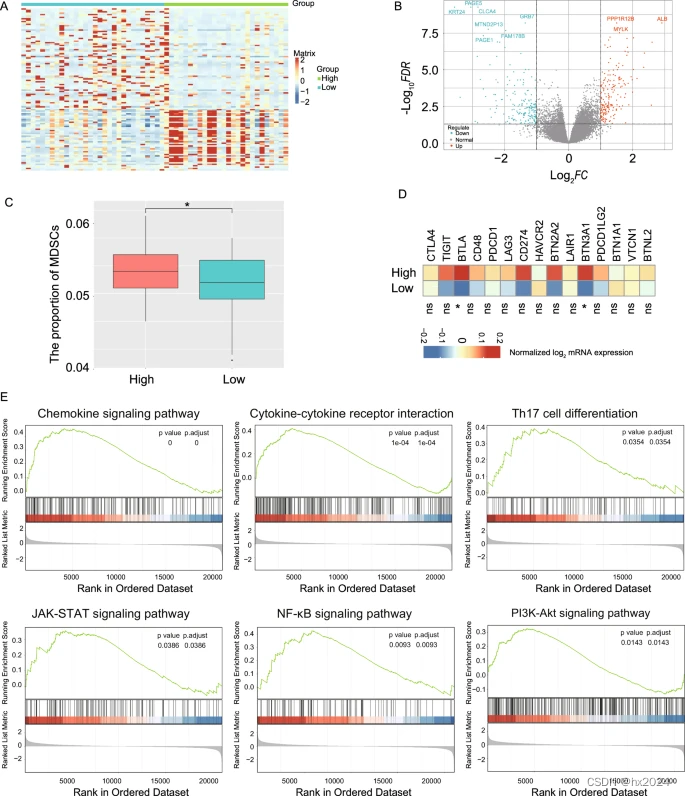
与高DPS相关的肿瘤抑制性免疫微环境的转录组学分析。热图显示了具有 TCGA-STAD 谱的高 DPS 组和低 DPS 组之间差异表达基因的表达水平。B Volcano图显示了高DPS组与低DPS组的差异表达基因。C 高DPS组和低DPS组MDSCs丰度的比较;D 低 DPS 组和高 DPS 组之间免疫共抑制剂的标准化 mRNA 表达水平。E GSEA结果显示高DPS组中六种代表性途径的富集。MDSC,髓源性抑制细胞;GSEA,基因集富集分析
文献:DeepRisk network: an AI-based tool for digital pathology signature and treatment responsiveness of gastric cancer using whole-slide images
这篇关于病理组学+配对 mIHC 验证+转录组多组学的文章就介绍到这儿,希望我们推荐的文章对编程师们有所帮助!







