本文主要是介绍新药(化药)注册申报资料都包含哪些?,希望对大家解决编程问题提供一定的参考价值,需要的开发者们随着小编来一起学习吧!
新药的注册申报是新药上市前的重要步骤,其流程可以简单概括为①前期准备→②申报材料准备→③递交注册申请→④审评和审批→⑤监管和跟踪。本文将着重介绍新药(化药)注册申报的一般流程和主要环节(附流程图)。(关于新药注册申报成功率和耗费时间问题写到最后)
①前期准备
在开始新药注册申报之前,研发机构需要进行充分的前期准备工作。这包括对新药的研究和开发,包括药物化学、药理学、毒理学、药代动力学等方面的研究。同时,还需要进行临床试验的设计和实施,以获取新药在人体内的安全性和有效性数据。此外,还需要准备相关的申报材料,包括药物说明书、药物质量标准等。

②申报材料准备
在准备申报材料时,需要按照国家药品监督管理局(NMPA)的要求进行,包括《药品注册管理办法》等相关法规和规范。申报材料需要包括新药的化学结构、药理学特性、药代动力学、毒理学、临床试验数据等信息。此外,还需要提供药物的质量标准、生产工艺等相关内容。

③递交注册申请
一旦申报材料准备完毕,研发机构需要将申请材料递交给国家药品监督管理局进行注册申请。递交注册申请时,需要填写相关的表格和申请表,并缴纳相应的费用。同时,还需要提供申请材料的电子版和纸质版。

④审评和审批
递交注册申请后,国家药品监督管理局将对申请材料进行审评和审批。审评的目的是评估新药的安全性、有效性和质量,判断是否符合上市的条件。审评过程包括对申请材料的审核、临床试验数据的分析和评估等。审评的结果将决定是否批准新药上市。
⑤监管和跟踪
一旦新药获得批准上市,国家药品监督管理局将对其进行监管和跟踪。监管的内容包括对生产企业的质量管理体系的审核和监督、对药物的质量和安全性进行抽样检验等。同时,还需要对药物的不良反应和临床使用情况进行监测和报告。
注意上述内容仅基于近段国内新药(化药)药品注册申报流程整理,而国内药品注册申报政策调整变化原因,在新药注册申报过程中遇到的本文未涉及内容,请及时跟当局相关管理部门沟通交流后,再确定相应解决方案。
最后说下在了解某个药品注册申报成功率和所耗费时间的问题,最好的方法就是通过调研相似药物在全球的研发进展情况,可以使用药物研发分析工具进行高效的分析预测,如下图:
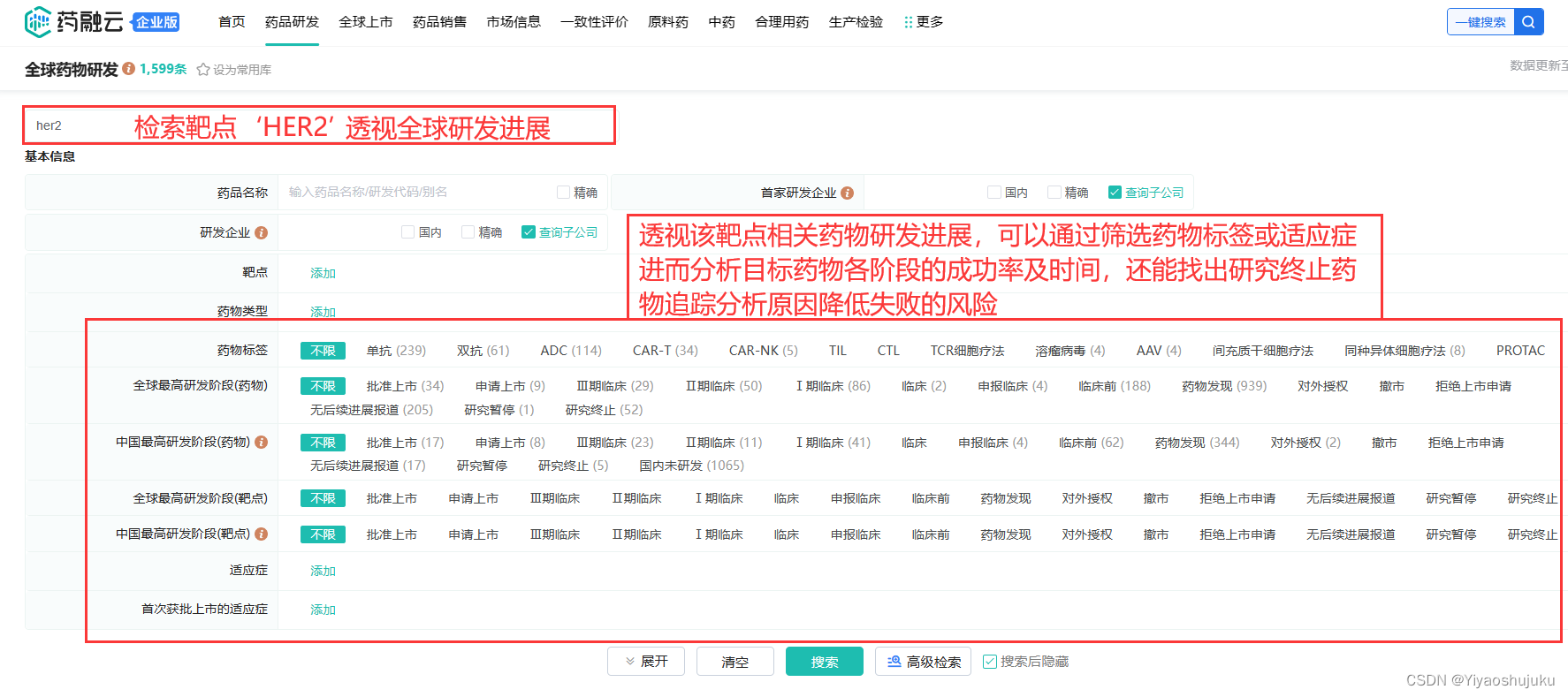
截图来源:药融云-全球药物研发数据库
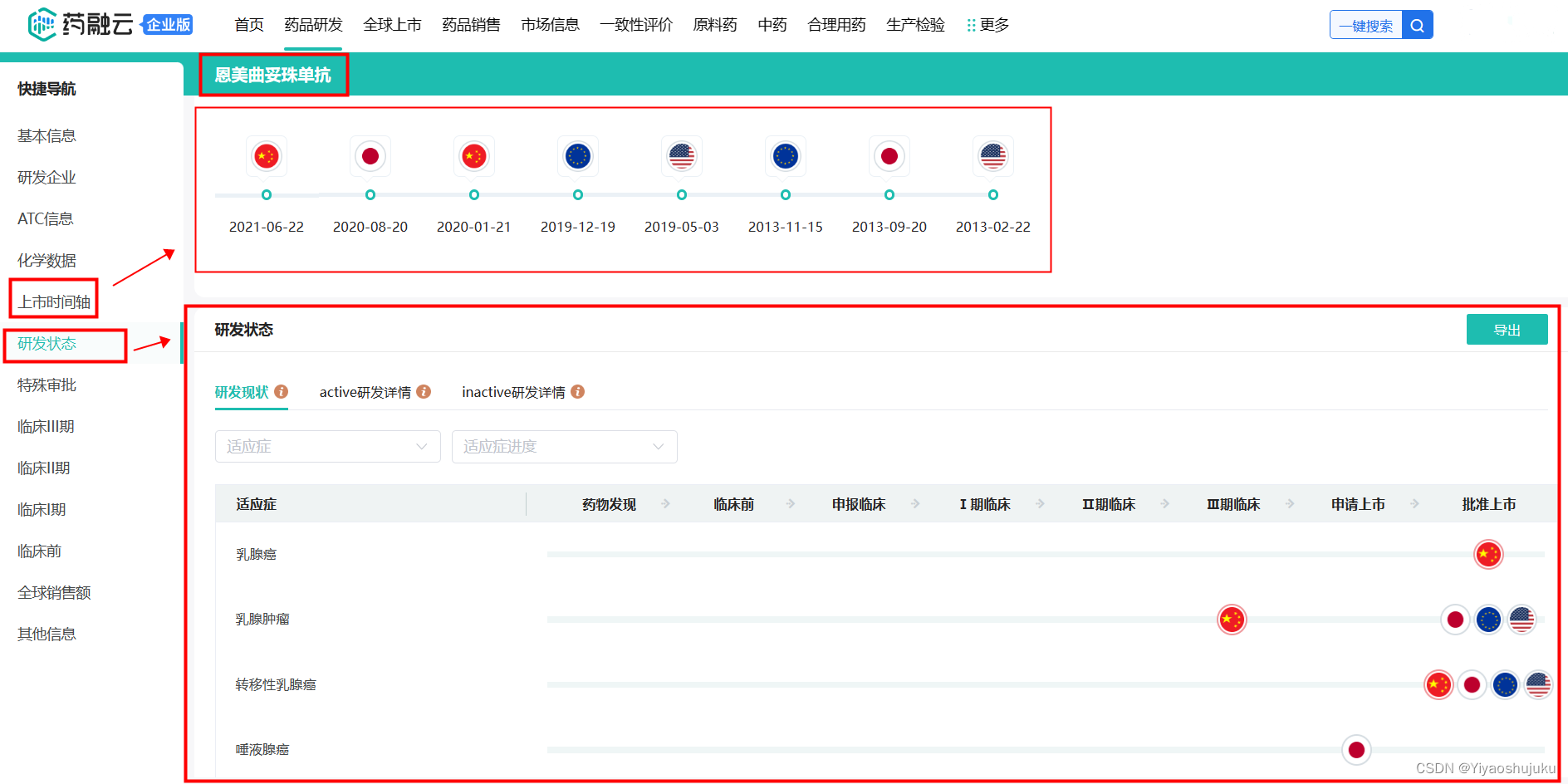
截图来源:药融云-恩美曲妥珠单抗(上市时间轴&研发状态)
这篇关于新药(化药)注册申报资料都包含哪些?的文章就介绍到这儿,希望我们推荐的文章对编程师们有所帮助!