本文主要是介绍最新研究!造血干细胞移植可能为MS患者提供长达10年的疾病豁免,希望对大家解决编程问题提供一定的参考价值,需要的开发者们随着小编来一起学习吧!
这项研究发表在2021年1月20日的《神经病学》在线期刊上,《神经病学》是美国神经病学会的医学杂志。MINNEAPOLIS-一项新研究表明,强烈免疫抑制后再进行造血干细胞移植,可以在治疗后长达10年的时间里,预防71%患有复发缓解型MS的人与多发性硬化症(MS)相关的残疾恶化。该研究还发现,在某些人中,他们的残疾在治疗10年后有所改善。另外,超过一半的继发性MS进展型患者在移植后10年未出现症状恶化。
虽然大多数MS患者首先被诊断为复发缓解型MS,其症状是先发作后出现缓解期,但许多复发缓解型MS的患者最终会转变为继发性进行性MS,其症状没有明显的波动,反而疾病缓慢,持续恶化。
该研究涉及自体造血干细胞移植,该移植使用参与者自身体内的健康血液干细胞替代患病细胞。
意大利热那亚大学医学博士Matilde Inglese博士说:“到目前为止,常规治疗已经阻止了MS患者遭受更多的发作和症状加重,但从长远来看却没有。”美国神经科学院院士。“先前的研究表明,超过一半的因疾病而服药的MS患者在10年内仍会恶化。我们的结果令人兴奋,因为他们表明,造血干细胞移植可能会阻止某人的MS残疾长期恶化。术语。”
该研究调查了从1997年至2019年接受干细胞移植的210例MS患者,他们的平均年龄为35岁。其中122例患有复发缓解型MS,86例患有继发性进行性MS,两名患有原发性进行性MS。
研究人员在移植后六个月,五年和十年对参与者进行了评估。
这项研究进行了五年,研究人员发现80%的人没有MS残疾恶化。到了10年大关,仍有66%的人没有经历残疾的恶化。
研究人员仅对患有最常见MS的人群进行研究,发现他们中有86%的人在移植五年后并未出现残疾恶化的情况。十年后,仍有71%的残疾人没有恶化。
同样,进行性MS患者也受益于干细胞移植。研究人员发现,这种类型的MS患者中有71%的人在移植五年后并未出现残疾恶化的情况。十年后,有57%的残疾人没有恶化。
英格莱斯说:“我们的研究表明,强烈的免疫抑制以及造血干细胞移植应被视为MS患者的一种治疗方法,尤其是那些对常规疗法无反应的患者。”
造血干细胞扩增、转染以及基因编辑优化解决方案
比尔盖茨曾经预言,未来能够超过微软公司的,必定出现在生物医药领域。而如果要问近几年什么生物医药技术最为火热,那么干细胞技术绝对是你得到的答案之一。
大家好,我是三三,很高兴和大家再次相约ZePingBIO。今天我们和大家一起讨论的是一种特殊的干细胞——造血干细胞。造血干细胞(hematepoietic stem cell, HSC) 又称为多能干细胞,是各种血细胞和免疫细胞的始祖。
当然,提起造血干细胞,首先我们将不得不感谢加拿大多伦多大学的三名科学家Ernest A. McCulloch 、 James E. Till与Siminovitch。1961年,Till和McCulloch默默无闻地在Radiation Research期刊上发表了他们最初的观察结果,从此为我们开启了干细胞研究的大门。而在随后的1961年,Till的博士后导师Siminovitch提出发现了造血干细胞。

Ernest A. McCulloch 与 James E. Till
时至今日, 造血干细胞(hematopoietic stem cells,HSC)在移植和临床治疗方面可谓应用广泛,结合基因治疗和基因编辑技术的进步,使得基于造血干细胞治疗多种血液疾病和免疫疾病的基因治疗研究在近年来取得了很大的进展。但是的但是,临床上常用的HSC源有骨髓、 动员的外周血及脐带血。由于这些组织中HSC含量很少,及组织相容性抗原特异的供者稀缺等问题, 导致许多病人无法获得足够量的组织相容性匹配的HSC。
因此,在所有的细胞治疗产品中,获得高产,高质量且有效的效应细胞是临床治疗的关键。对于基因编辑CD34+造血干细胞疗法同样如此。
那么,造血干细胞的这些难题究竟该怎么解决呢?不捉急,三三今天为大家带了一整套造血干细胞优化解决方案,请大家审阅:
造血干细胞供应方案
众所周知,人脐带血CD34+细胞含有造血干细胞和祖细胞,相比其他人体组织来源的造血干细胞,脐带血CD34+造血干细胞更幼稚,可以避免供体和受体HLA (Human Leukocyte Antigen ,人白细胞抗原)不匹配的问题,是移植、自身免疫性疾病、干细胞研究的理想模型。ZePingBio代理的LONZA原代细胞产品供体来源丰富,本款冷冻保存的人脐带血CD34+造血干细胞,由单个健康供体的脐带血单核细胞(MNCs)通过阳性免疫磁性分离得到,并通过CD34+表达验证,可保证纯度≥90%。其所有细胞均不含有HIV-1和乙型肝炎,每个批次细胞均可提供质量分析报告。每支含有≥1,000,000个细胞。
| 货号 | 描述 | 规格 |
| 2M-101 | 骨髓来源CD34+ 造血干细胞 | ≥100,000 cells |
| 2M-101A | 骨髓来源CD34+ 造血干细胞 | ≥300,000 cells |
| 2M-101B | 骨髓来源CD34+ 造血干细胞 | ≥500,000 cells |
| 2M-101C | 骨髓来源CD34+ 造血干细胞 | ≥1 million cells |
| 2M-101D | 骨髓来源CD34+ 造血干细胞 | ≥2 million cells |
| 2C-101 | 脐带血来源CD34+造血干细胞 | ≥1 million cells |
| 2C-101A | 脐带血来源CD34+造血干细胞 | ≥500 000 cells |
| 4Y-101C | 人CD34+ 造血干细胞分离自动员外周血(使用免疫磁珠阳性分选) | ≥1 million cells |
| 4Y-101D | 人CD34+ 造血干细胞分离自动员外周血(使用免疫磁珠阳性分选) | ≥5 million cells |
| 4Y-101E | 人CD34+ 造血干细胞分离自动员外周血(使用免疫磁珠阳性分选) | ≥10 million cells |
| 4Y-101F | 人CD34+ 造血干细胞分离自动员外周血(使用免疫磁珠阳性分选) | ≥25 million cells |
除此之外,北京泽平代理LONZA骨髓CD34+细胞,供体丰富,不论是需要单一供体大量细胞的研究,还是对不同年龄、性别、种族供体细胞间差异的研究,均可获得理想的细胞产品。
造血干细胞培养扩增解决方案
大家都知道,影响脐血CD+34细胞体外扩增的因素有很多,纵观近年来,关于基础研究结果发现了一系列有助于扩增HSC的培养体系及添加物,如细胞因子(SCF、TPO、FLT-3L、IL-3、IL-6、G-CSF等)、与基质细胞共培养,以及添加一些小分子物质(前列腺素E2)等 ,又或者进一步纯化脐带血干细胞以其获得体外扩增,但是这些方法获得的HSC仍不能满足临床需要。ZePingBio代理的LONZA推荐使用其明星产品X-VIVO系列无血清培养基作为替代培养基培养造血干细胞。其中X-VIVO 15 系列,支持包含造血干细胞、单核细胞、巨噬细胞、淋巴细胞等多种细胞的增殖。
人脐血来源的CD34+造血干细胞培养在含rec human TPO (25ng/mL),Rlt3 ligand (25ng/mL),SCF (13ng/mL)的X-VIVO 15中。预包被纤连蛋白。用Nanolive的3D Cell Explorer 进行15h的活细胞成像(每分钟3张图像)。
| 货号 | 描述 | 规格 |
| 04-418Q | X-VIVO 15 免疫细胞培养基,RUO | 1L |
| BEBP02-054Q | TheraPEAK X-VIVO 15免疫细胞培养基,GMP | 1L |
| BE08-879H | TheraPEAK X-VIVO 15免疫细胞培养基,GMP | 5L |
造血干细胞培养扩增解决方案
原始的造血干细胞由于其全能性,能再生整个造血系统和免疫系统,是基因治疗的理想靶细胞。就三三随了解到的,目前造血干细胞目前主要的转染方式有:腺病毒转染、逆转录病毒和慢病毒转染、转座子和人工染色体转染。而今天三三推荐的一种已成熟应用于CAR-T细胞的研究中,并且可高效转染造血干细胞的方式,4D Nucleofector核转仪系统。

4D Nucleofector核转仪系统(戳我查看技术详情)
更值得一提的是,4D Nucleofector核转系统转染造血干细胞不仅操作简单,而且可支持大规模的造血干细胞转染生产,多数细胞系转染效率可高达50-70%,部分原代细胞转染效率可超过90%。
| 货号 | 描述 | 规格 |
| AAF-1002B | 4D Nucleofector Core unit | 1/pkg |
| AAF-1002X | 4D Nucleofector X unit | 1/pkg |
| AAF-1002L | 4D Nucleofector LV unit | 1/pkg |
造血干细胞基因编辑解决方案
我们都知道,造血干细胞具有自我更新和分化为各类血细胞的潜能,一直被认为是最理想的基因治疗靶细胞之一。近年来,基于慢病毒载体的造血干细胞基因治疗逐渐进入临床,同时,随着CRISPR-Cas9等基因编辑技术的不断发展,第二代造血干细胞精准基因治疗研究已经取得重要进展。ZePing代理国际知名CRISPR技术服务商IDT(Integrated DNA Technologies公司)的CRISPR基因编辑产品。可支持造血干细胞的基因编辑方面的研究。
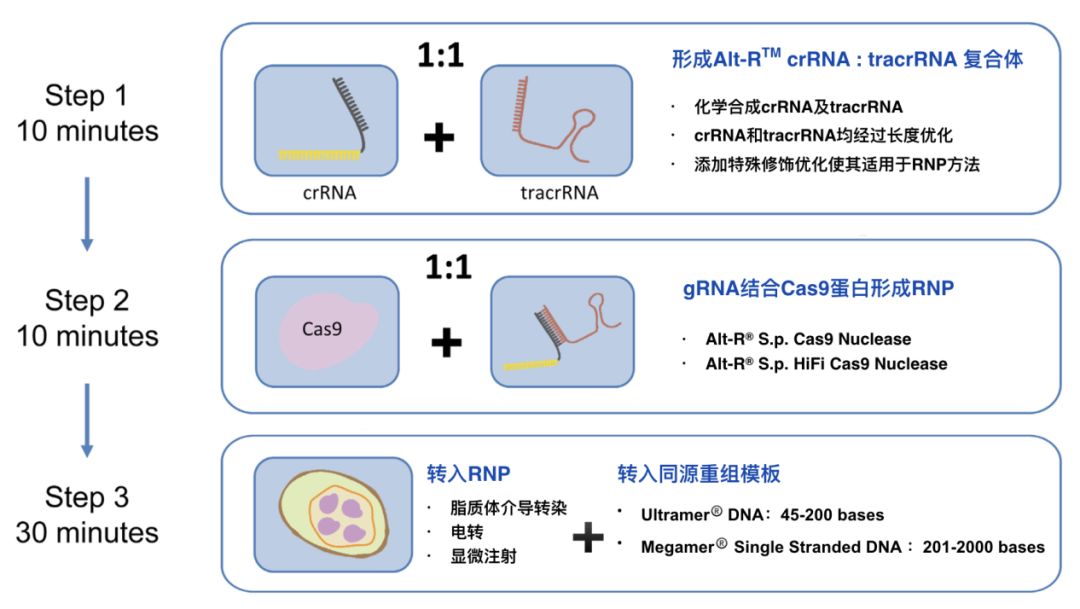
IDT Alt-R® CRISPR/Cas9 实验流程(戳我查看技术详情)
| 货号 | 产品 | 规格 |
| Alt-R®CRISPR-Cas9 crRNA | 10 nmol | |
| Alt-R®CRISPR-Cas9 crRNA XT | 10 nmol | |
| 1072534 | Alt-R®CRISPR-Cas9 tracrRNA | 100 nmol |
| 1075927 | Alt-R®CRISPR-Cas9 tracrRNA,ATTO™550 | 5 nmol |
| Alt-R®CRISPR-Cas9 sgRNA | 10 nmol |
参考文献(上下滑动查看)
1 Wang L, Gu ZY, Liu SF, et al. Single-versus Double-Unit umbilical cord blood transplantation for hematologic diseases: a systematic review[J]. Transfus Med Rev, 2019, 33(1):51-60.
2 Pineault N, Abu-Khader A. Advances in umbilical cord blood stem cell expansion and clinical translation[J]. Exp Hematol, 2015, 43(7):498513.
3 Pineault N, Cortin V, Boyer L, et al. Individual and synergistic cytokine effects controlling the expansion of cord blood CD34+ cells and megakaryocyte progenitors in culture[J]. Cytotherapy, 2011, 13(4): 467-480.
4 Codispoti B, Rinaldo N, Chiarella E, et al. Recombinant TATBMI-1 fusion protein induces ex vivo expansion of human umbilical cord blood-derived hematopoietic stem cells[J]. Oncotarget, 2017,
8(27):43782-43798.
5 Jiang MM, Chen HD, Lai SJ, et al. Maintenance of human haematopoietic stem and progenitor cells in vitro using a chemical cocktail[J]. Cell Discov, 2018, 4:59.
6 Boitano AE, Wang J, Romeo R, et al. Aryl hydrocarbon receptor antagonists promote the expansion of human hematopoietic stem cells[J]. Science, 2010, 329(5997):1345-1348.
7 Fares I, Chagraoui J, Gareau Y, et al. Pyrimidoindole derivatives are agonists of human hematopoietic stem cell self-renewal[J]. Science, 2014, 345(623):1509-1512.
8 徐诗琪, 丁亚辉, 张宇, 等. UM171体外扩增脐血造血干细胞的机制 [J]. 中国组织工程研究, 2018, 22(21):3328-3334.
这篇关于最新研究!造血干细胞移植可能为MS患者提供长达10年的疾病豁免的文章就介绍到这儿,希望我们推荐的文章对编程师们有所帮助!






