本文主要是介绍聚焦“泛素化修饰”的生信分析思路,希望对大家解决编程问题提供一定的参考价值,需要的开发者们随着小编来一起学习吧!
今天给同学们分享一篇泛素化+分型+预后的生信文章“Establishment and validation of a ubiquitination-related gene signature associated with prognosis in pancreatic duct adenocarcinoma”,这篇文章于2023年6月9日发表在Front Immunol期刊上,影响因子为8.738。

胰管腺癌(PDAC)通常被称为“癌症之王”。其预后极差,是全球癌症相关死亡的第四大原因。由于PDAC早期缺乏特异性临床表现,只有少部分个体能够在早期被确定诊断,而绝大多数人在更晚期被诊断出来。尽管近年来在PDAC的系统治疗方面取得了突破,但晚期疾病的预后仍然令人沮丧,这是由于该疾病的局部快速进展和频繁的远处转移。因此,找到一些可能调控PDAC发生和进展的关键基因,并作为PDAC的新型治疗靶点,非常重要。
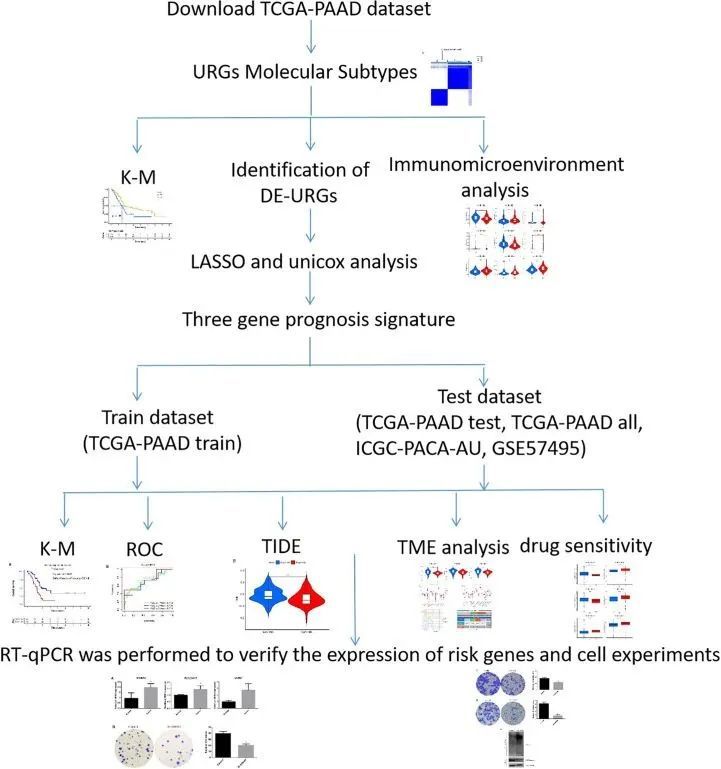
图1 当前研究的流程图
1. PDAC中URGs集群的鉴定
首先,使用一种共识聚类方法分析了URGs表达与PDAC亚型之间的关联。如图2A-C所示,应用CDF曲线将PDAC患者分为两个聚类(C1和C2)。与C2相比,被诊断为PDAC的C1个体的存活期明显较短(图2D)。图2E展示了URG聚类、临床特征和PDAC患者URGs表达之间的相关性。大多数URGs在C1中的表达较C2高,而C1样本的分级较高,而T、N、分期、年龄和性别在C1和C2之间没有显著差异。
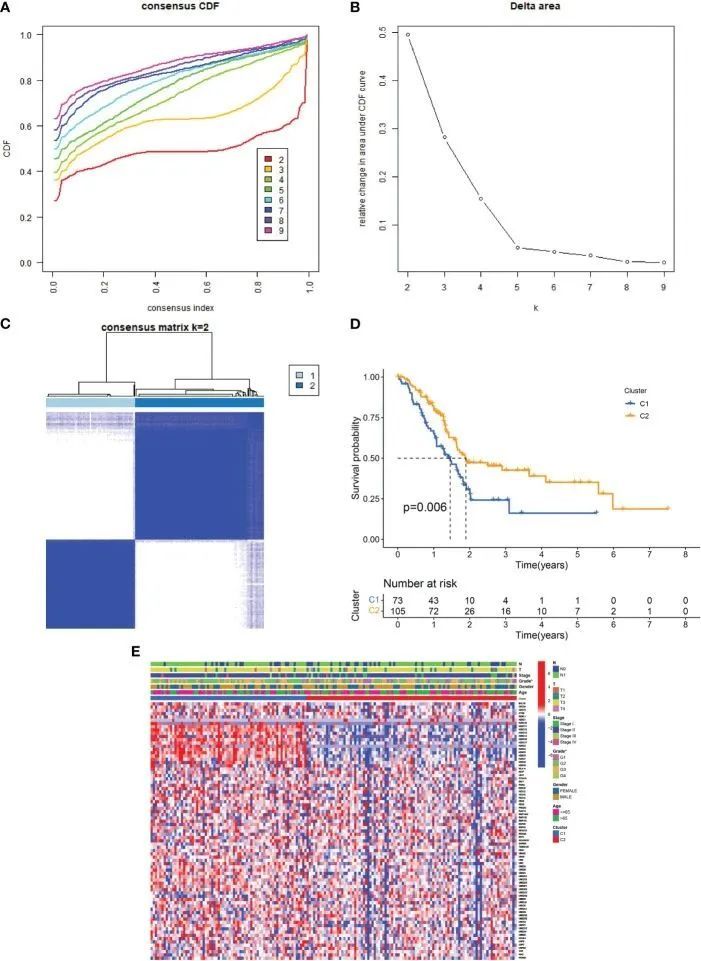
图2 URG亚型和两个亚型中PDAC样本的临床特征
由于免疫细胞在PDAC的发生和进展中起着重要作用,作者接下来评估了两个亚型之间浸润免疫细胞的变化。在亚型2中,单核细胞、静息型肥大细胞、原始B细胞和CD8 T细胞的水平高于亚型1,而调节性T细胞、嗜酸性粒细胞、巨噬细胞M0和活化型肥大细胞的水平低于亚型1。
2. 发展和验证与泛素化相关的预后标志
使用“limma”程序,在|log fold change (FC)| >1和FDR < 0.05的标准下,在两个聚类之间找到了996个差异表达基因(DEGs)。随后,确定了43个与泛素化相关的DEGs,它们在PDAC和正常组织之间的表达水平明显不同(图3A、B)。接下来,通过单变量Cox分析找到了12个与预后相关的DEGs。随后,作者进行了LASSO分析,去除了过拟合的基因,创建了3个基因(SLC22A17、UCHL1和S100A2)的URGs标志(图3C、D)。
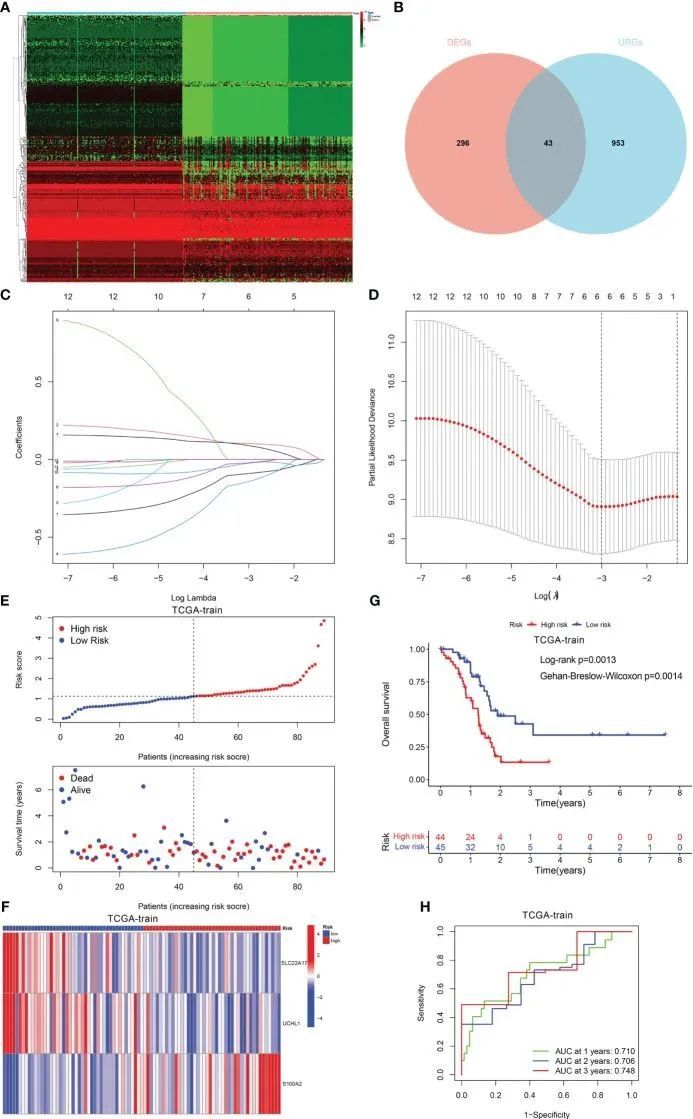
图3 预后标记的构建
PDAC患者根据中位风险评分值被分为低风险和高风险两类(图3E)。图3F展示了这两个基因在两个风险类别之间的表达变化。此外,风险评分较高的患者有更高的死亡率(图3G)。此外,作者进行了ROC曲线评估URGs标志,结果显示1年、2年和3年期间的AUC值分别为0.710、0.706和0.748(图3H)。
此外,作者在测试数据集中验证了上述发现。测试数据集中的所有PADC患者也被分为低风险和高风险类别。KM分析显示,与TCGA-test、TCGA-all和ICGC-PACA-AU中高风险患者相比,低风险个体的预后更为有利(图4A-C)。在TCGA-test中,1年、2年和3年期间的ROC曲线下面积(AUC)值分别为0.738、0.654和0.723(图4D);在TCGA-all中,AUC值分别为0.723、0.707和0.704(图4E);在ICGC-PACA-AU中,AUC值分别为0.726、0.738和0.759(图4F)。此外,另一个测试数据集GSE57495也用于验证。高风险评分的患者具有更高的死亡率,1年、2年和3年期间的AUC值分别为0.706、0.733和0.871。
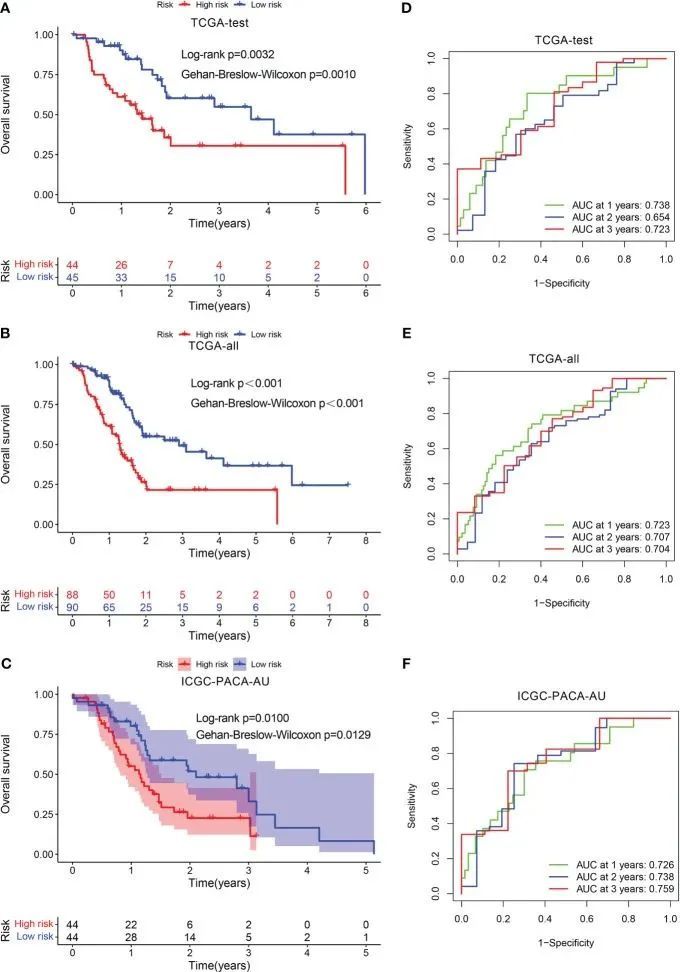
图4 预后标志的验证
3. PDAC的列线图构建
多变量和单变量Cox回归分析证明风险评分独立地作为一个强有力的预后标志物(P < 0.05)(图5A,B)。利用训练数据集中的URG标记和临床变量开发了一种创新的图表,以进一步挖掘URG标记的预后潜力(图5C)。预测的1年、2年、3年生存率与实际观察结果接近(图5D)。此外,进行了ROC分析以评估图表的预后预测价值。对于1年生存时间,AUC值为0.745,0.731(风险评分)(图5E)。对于2年生存时间,AUC值为0.776,0.680(风险评分)(图5F)。对于3年生存时间,AUC值为0.802,0.708(风险评分)(图5G)。这些结果表明,这种新颖的图表可以作为一个出色的预后预测模型。
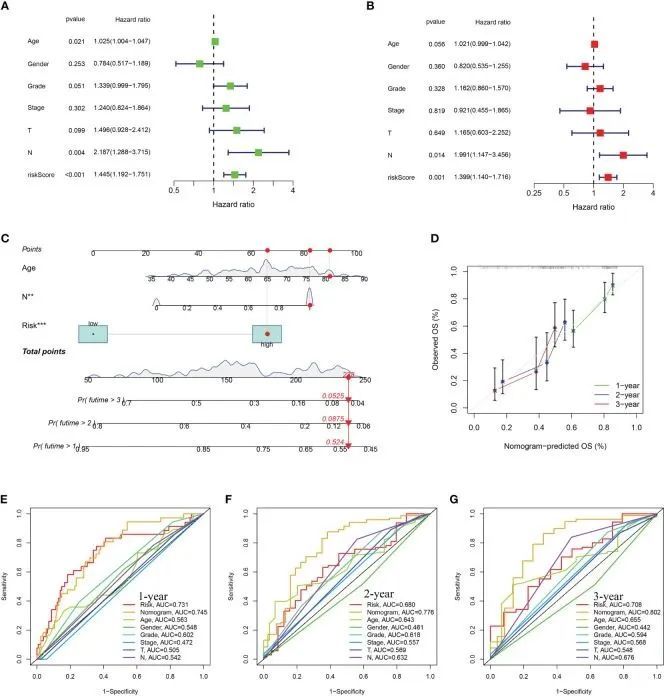
图5 构建和评估图表
6. 高风险组和低风险组的肿瘤微环境分析
TME在肿瘤的生物行为中起着关键的指示作用。ESTIMATE分析显示,高风险类别中的ImuneScores、StromalScores和ESTIMATEScores均较低,与低风险类别相比(图6A)。ssGSEA分析发现,高风险患者中B细胞、CD8+ T细胞、DCs、iDCs、中性粒细胞、肥大细胞、辅助T细胞、肿瘤浸润细胞(TIL)和调节性T细胞(Treg)的浸润较低,与低风险患者相比(图6B)。一些免疫功能,包括T细胞共刺激、CCR、II型干扰素反应和T细胞共抑制,在低风险患者中也得到改善(图6C)。此外,通过CIBERSORT、MCPCOUNTER、QUANTISEQ、EPIC、TIMER、CIBERSORT-ABS和XCELL还研究了两个风险组之间免疫细胞水平的差异。根据研究结果,低风险类别在大多数免疫细胞中,包括原始CD4 T细胞、CD8 T细胞、DCs、癌相关成纤维细胞、NK细胞、B细胞和单核细胞,水平明显较高(图6D)。这可能解释了为什么低风险类别具有更好的预后。此外,图6E展示了多个免疫亚型中低风险和高风险个体的分布情况。
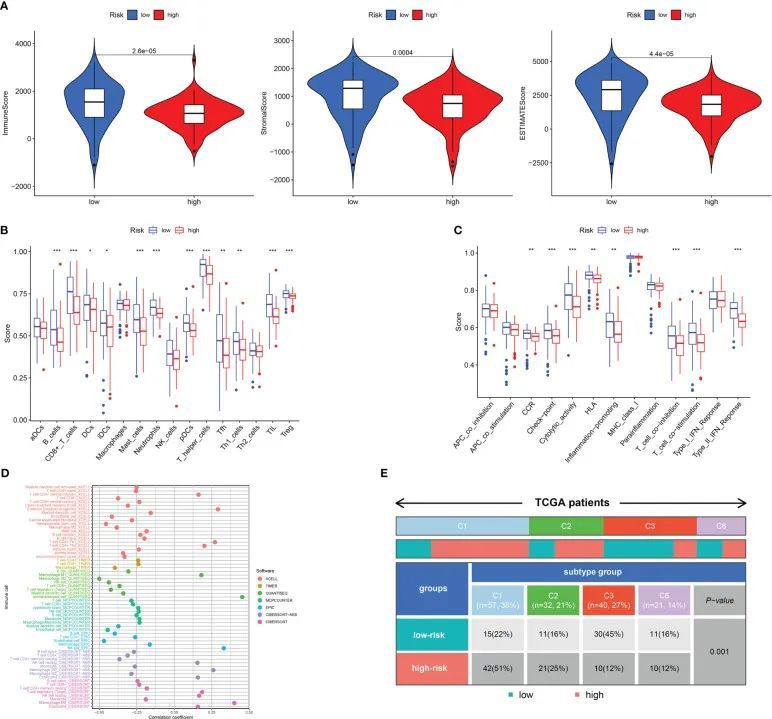
图6 高风险组和低风险组的免疫状况分析
作者接下来对低风险和高风险患者的免疫相关基因表达模式进行了研究。大多数免疫相关基因在高风险类别中表达水平较低(图7A-D)。TIDE分数是免疫治疗反应的重要生物标志物。作者还研究了TIDE分数与风险分数之间的关联。与低风险类别相比,高风险类别的TIDE分数较低(图7E)。此外,与低风险患者相比,高风险患者对免疫治疗的反应更好(图7F)。
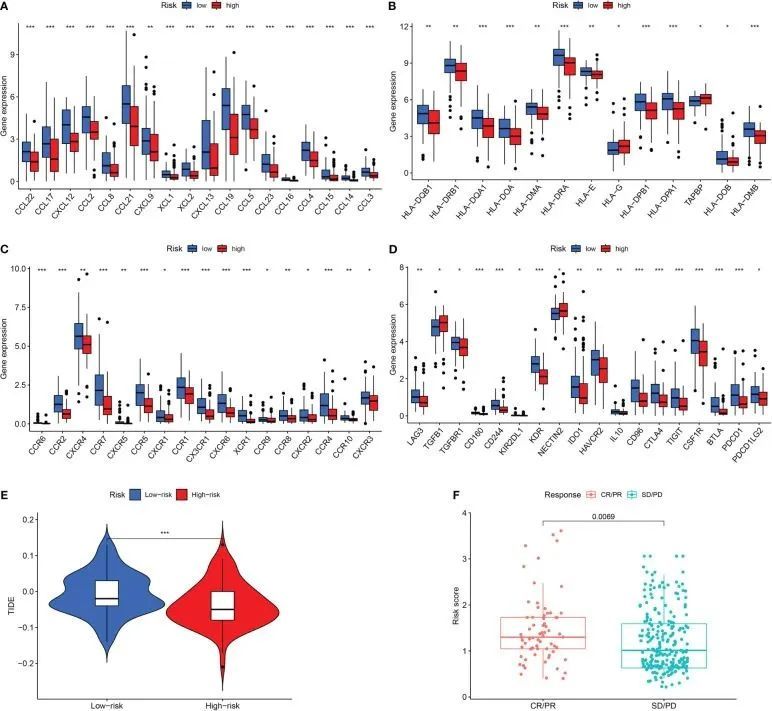
图7 高风险组和低风险组的免疫治疗反应评估
7. URG标记的突变和功能评估的比较分析
对高和低URG得分的PDAC的体细胞突变进行了检查,以充分描述URG得分的病理生物学意义。高URG得分组与低URG得分组相比,体细胞突变频率更高(94.05%与70.51%)(图8A,B)。进行了GO、KEGG和DO富集分析,以研究DEGs的潜在生物学作用。因此,GO结果显示DEGs主要富集于信号释放、质膜外侧和抗原结合(图9A,C)。KEGG结果表明DEGs主要富集于胰岛素分泌、cAMP信号通路和趋化因子信号通路(图9B)。DO结果表明DEGs主要富集于细胞类型良性肿瘤、腺癌和胰腺疾病(图9C)。此外,GSVA表明高风险和低风险PDAC患者之间的许多途径发生了实质性改变(图9D)。
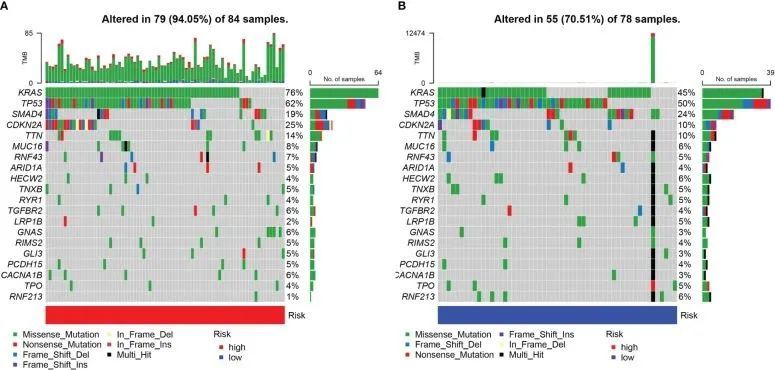
图8 高风险组(A)和低风险组(B)中的体细胞基因突变
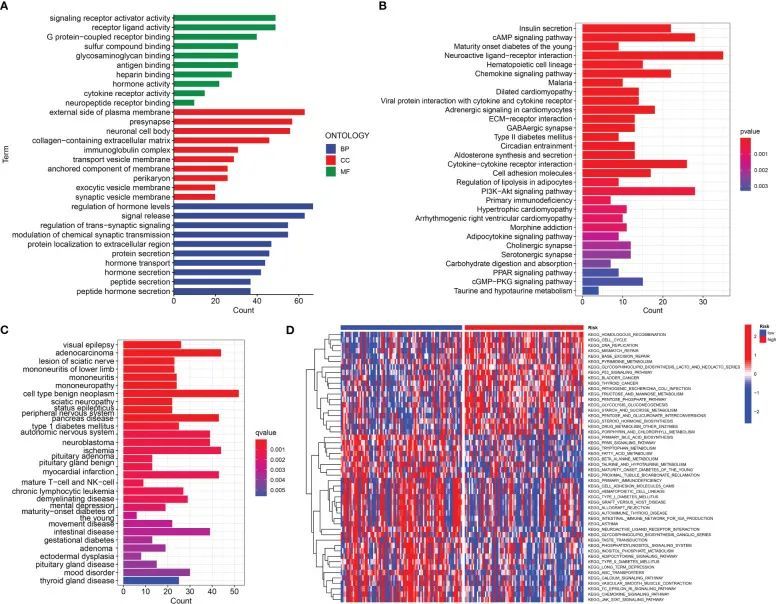
图9 富集分析
8. 药物敏感性和风险评分的相关性分析
作者将PDAC患者的风险评分与化疗和靶向治疗药物的IC50值进行相关分析,以了解低风险和高风险类别之间药物敏感性可能存在的差异。17-AAG和PD-0325901的IC50值在低风险组中显著较高,而Phenformin、Axitinib、AZD8055和TAK-715的IC50值在低风险组中较低(图10)。
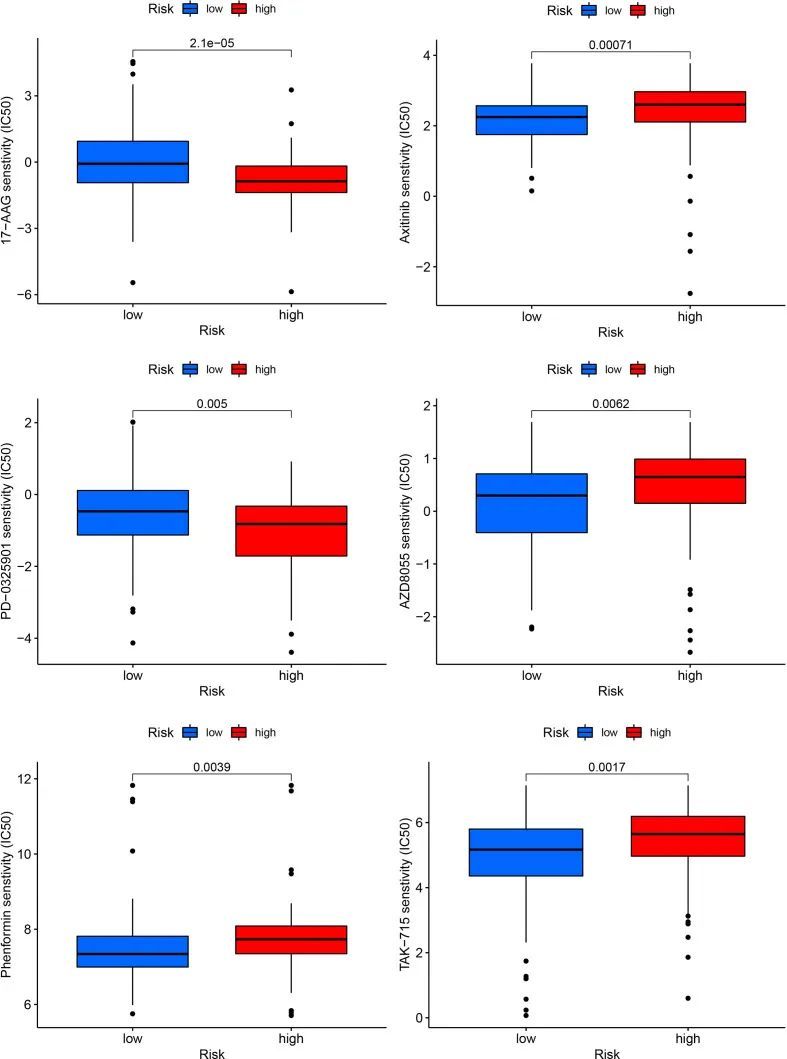
图10 高风险和低风险组的药物敏感性分析
9. S100A2的敲除抑制了胰腺癌的恶性生物行为
首先,作者通过RT-qPCR检测了三个风险基因的表达。结果显示,胰腺癌组织中三个风险基因的表达高于正常胰腺组织(图11A)。接下来,作者在PANC-1细胞中敲低了S100A2,以探究S100A2在胰腺癌中的作用。结果显示,S100A2敲低减少了PANC-1细胞的克隆、迁移和侵袭能力(图11B-D)。此外,发现S100A2敲低增加了β-连环蛋白的泛素化,从而降低了其蛋白表达(图11E)。这些结果表明,S100A2敲低可能通过增加β-连环蛋白的泛素化来抑制胰腺癌细胞的恶性生物行为。
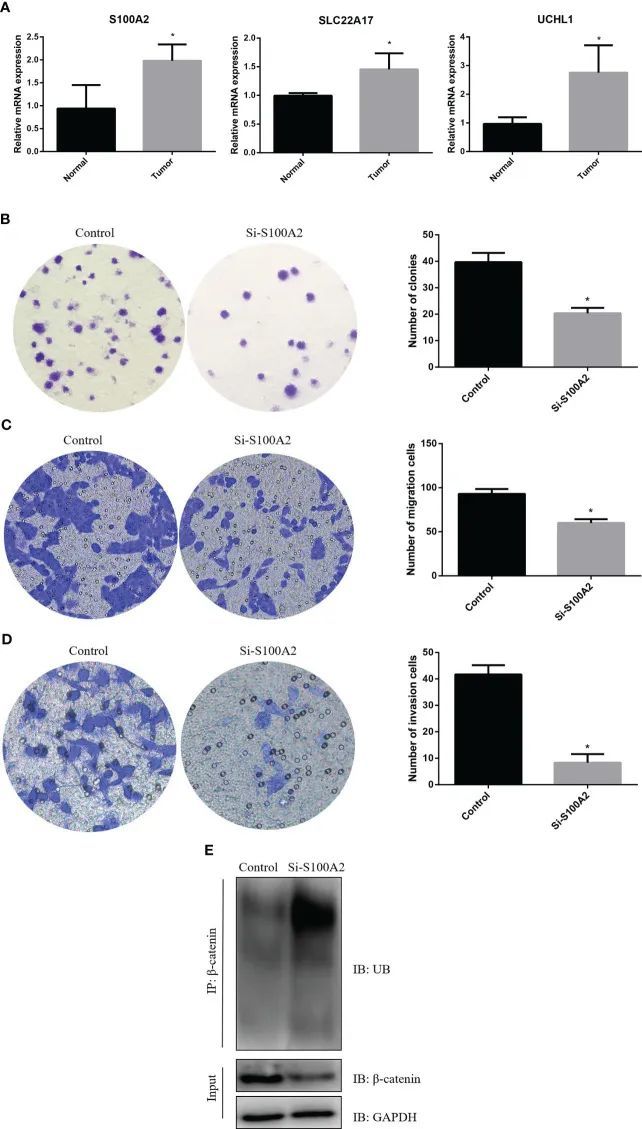
图11 S100A2敲低抑制PDAC细胞的恶性生物学行为
总结
总之,作者设计了一个基于URGs的分子亚型和预后标志,有助于预测生存、指导免疫治疗和确定临床结果。这项研究可能为作者深入了解PDAC中泛素化的功能提供了更深层次的见解,并促进了更有效的治疗方法的发展。
这篇关于聚焦“泛素化修饰”的生信分析思路的文章就介绍到这儿,希望我们推荐的文章对编程师们有所帮助!





