本文主要是介绍169v 条目不存在_铜催化的频哪醇硼烷对1,3烯炔的不对称硼氢化反应获得手性烯丙基硼酸酯...,希望对大家解决编程问题提供一定的参考价值,需要的开发者们随着小编来一起学习吧!
作者报告了由Cu(OAc)和(S,S)-Ph-BPE生成的催化剂对1,3-炔烃的铜催化对映选择性硼氢化。各种各样的烷基和芳基取代的1,3-烯炔与频哪醇硼烷进行这种不对称硼氢化反应,以高收率和高至优异的对映选择性(高达99%ee)产生相应的烯丙基。这种不对称转变可耐受各种反应性基团,例如氯,溴,三氟甲基醚,甲硅烷氧基,羧酸酯和亚氨基官能团。
有机硼酸酯化合物因其无毒,高稳定性和高官能团相容性而成为有机合成中有用的结构单元。与已广泛用于催化交叉偶联反应的芳基硼酸酯和链烯基硼酸酯相比,在有机合成中,尽管它们有可能被用作其他烯丙基化合物的前体,烯丙基硼酸酯化合物也几乎没有得到研究。这可能是由于缺乏通用的直接合成烯丙基硼酸酯的方法。乙烯基硼酸酯可以方便地由易得的起始原料(如烯烃或炔烃)通过脱氢硼化作用或硼氢化来制备。然而,由易得的起始原料合成烯丙基硼酸酯的开发尚不完善。另外,在开发对映选择性方法以制备光学纯的烯丙基硼酸酯化合物的过程中,烯丙基硼酸酯的轴向手性可能带来额外的困难。
1,3-烯炔的硼氢化代表了一种经济的合成烯丙基硼酸酯化合物的方法。早期关于烯丙基硼酸酯合成的研究仅限于通过Pd(0)催化的1,3-烯炔的硼氢化反应制备外消旋的烯丙基硼酸酯。2016年,Szabó报告了通过炔丙基环丙烷,环氧化物和环烷基的硼基开环合成外消旋烯丙基硼酸酯。在1993年,Hayashi研究了使用手性MOP配体的钯催化剂通过1,3-炔烃的不对称硼氢化反应合成对映异构体富集的烯丙基硼酸酯,但是这种不对称转化的对映选择性中等(40-60%ee)。2008年,Ito和Sawamura报道了通过铜(I)催化的碳酸炔丙酯被二硼烷立体专一取代的不对称合成手性烯丙基硼酸酯,但需要对映体富集的碳酸炔丙酯。因此,开发高对映选择性的方案来合成手性烯基硼酸酯特别重要,但仍然是一个挑战。
近来,手性铜配合物已经成为烯烃的硼氢化,硅氢加成和加氢胺化反应的活性催化剂。 1,3-烯炔的功能化也已经用铜催化剂进行了研究。例如,Buchwald最近报道,使用手性Cu-H催化剂将1,3-炔烃衍生的手性亲核试剂不对称加成到羰基化合物上,从而获得含有内部炔烃单元的手性醇。即使DFT计算研究表明,对于1,3-烯炔插入,烯丙基铜中间体的形成比炔丙基铜的形成更容易,但未获得丙二烯产物。受作者最近对开发用于不饱和有机分子转化的碱金属催化剂研究兴趣的驱动,作者对开发从1,3-炔烃不对称合成对映体富集的烯丙基硼酸酯化合物的实用方案感兴趣,1,3-炔烃可以通过末端炔烃与乙烯基溴的Sonogashira偶联反应轻松制备。在此,作者报道了高度对映选择性的铜催化的1,3-烯炔与HBpin的硼氢化反应合成手性烯基硼酸酯。
作者选择了but-3-en-1-yn-1-ylbenzene(1a)与HBpin的反应来评估该Cu催化的不对称硼氢化反应的条件。测试了由Cu(OAc)和一系列双膦配体以及其他反应参数(溶剂和温度)生成的各种铜催化剂。表1总结了所选择的实例。通常,这些反应以1,3-烯炔1a作为限制性试剂,HBpin(1.25当量)略微过量,在5 mol%的Cu(OAc)和6 mol%的双膦配体存在的情况下,在5 oC下进行20 h。
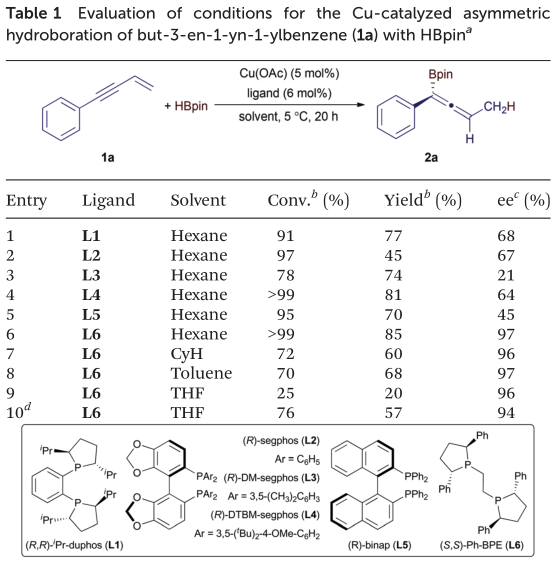
在由Cu(OAc)和手性双膦配体(L1-L6)在己烷中生成的铜催化剂进行的反应中(表1中的条目1-6),该反应由Cu(OAc)和(S,S)-Ph-BPE(L6)进行1,3-烯炔1a的完全转化,并以高收率得到具有良好对映选择性的丙二烯产物2a(条目6)。然后,在各种溶剂中对Cu(OAc)/ L6催化的反应进行了测试(表1中的条目7-9),发现溶剂对对映选择性没有明显影响,但对2a的收率有明显影响。在环己烷,甲苯或THF中的反应产生了不同数量(5-10%)的副产物,该副产物是由丙二烯2a氢化形成的(条目7-9)。另外,在THF中进行的反应的1a的低转化率导致所得到的丙二烯2a的低产率(条目9)。
借助活性铜催化剂和所确定得条件(表1中的条目6),作者研究了这种铜催化的不对称硼氢化反应的芳基取代的1,3-烯炔的范围,这些结果总结于表2中。
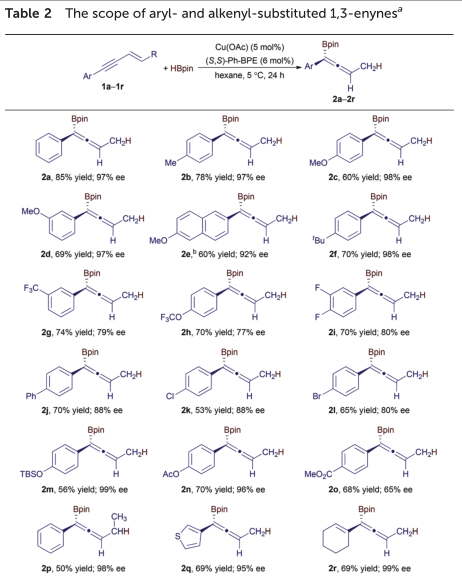
各种包含对位和间位取代芳基的1,3-烯炔进行反应,以高收率(50-85%)和高对映体选择性(77-99%ee)获得相应的烯丙基硼酸酯(2a-2q)。另外,烯基取代的1,3-烯炔也以高分离产率(69%)和优异的对映选择性(99%ee)反应产生烯丙基硼酸酯(2r)。
表2中的数据表明1,3-烯炔的芳基的电子性质对该Cu催化的硼氢化反应的对映选择性具有显着影响。例如,与含电子中性和富电子芳基的1,3-炔烃相比(2a-2c的ee为97-98%),含电子不足的芳基的1,3-烯炔的反应具有较低的对映选择性(2g-2l和2o的对映体选择性为65-88%ee)。铜催化的1,3-炔烃的不对称硼氢化反应可耐受多种反应性官能团,例如醚(2c–2e),三氟甲基醚(2h),氟(2i),氯(2k),溴(2l),甲硅烷氧基(2m)和酯(2n和2o)。另外,还容许含有噻吩的1,3-烯炔(1q),并且该1,-烯炔反应以良好的收率(69%)和高的对映选择性(95%)提供了烯丙基硼酸酯2q。
与表2中列出的芳基取代的1,3-烯炔的硼氢化反应不同,脂族取代的烯炔的硼氢化在5 oC下在24小时内进行了低转化率。因此,作者在室温下对脂族取代的1,3-烯炔进行了硼氢化处理12小时,以实现这些烯炔的高转化率。表3总结了经历此反应的烷基取代的1,3-烯炔的范围铜催化的对映选择性硼氢化。
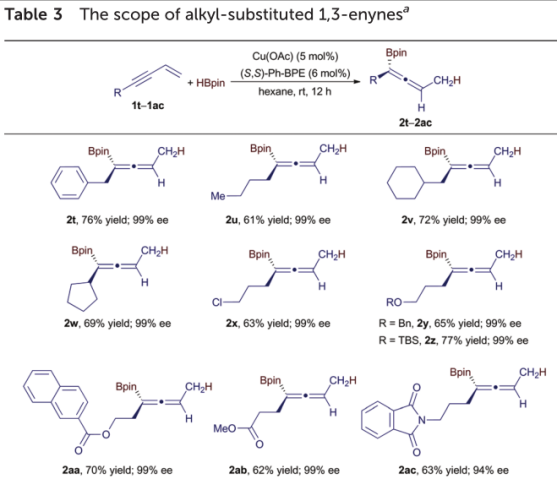
通常,各种含有伯或仲官能化烷基的1,3-烯炔反应生成相应的烯丙基硼酸酯(表3中的2t–2ac),分离产率高(61–76%),对映选择性(99%)好ee)。含有反应性基团的1,3-烯炔(例如氯(2x),苄基醚(2y),甲硅烷氧基(2z),酯(2aa和2ab)和亚氨基(2ac))与反应条件兼容。
为了突出此对映选择性方案的合成效用,作者进行了丁-3-烯-1-yn1-基苯(1a,8.0 mmol)与频哪醇硼烷的克级反应(方案1A)。
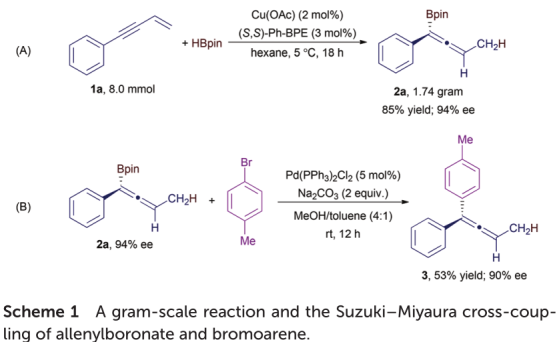
该反应在降低的铜催化剂负载(2 mol%)的存在下于5°C在18 h内进行1a的完全转化,得到烯丙基硼酸酯2a,其产率为85%,对映选择性为94%ee,为与相应反应的可比性相比,规模较小(表2中的2a)。此外,还表明,在室温下,在5 mol%钯催化剂存在下,烯丙基硼酸酯2a与4-溴甲苯进行了Suzuki-Miyaura交叉偶联反应(方案1B),该反应提供了被双(芳基)取代的化合物分离出53%的丙二烯3,不损失对映体纯度。
为了初步了解这种Cu催化的硼氢化反应,作者用but-3-en-1-yn-1-ylbenzene(1a)和DBpin(eqn.(1))进行了氘标记实验。
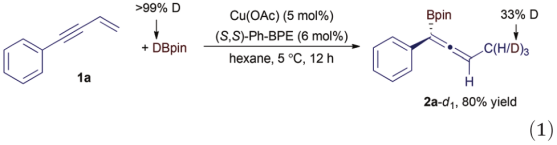
该反应以80%的产率产生了烯丙基硼酸酯2a-d1,并且氘仅位于2a中的甲基上。该实验的结果表明,这种Cu催化的反应是将1,3-烯炔中的烯烃单元以2,1-迁移的方式插入到Cu-H中间体中。
根据氘标记实验的结果以及铜催化的烯烃和1,3-烯炔的加氢官能化的先例,作者对这种Cu催化的不对称硼氢化提出了一种具有Cu(I)-H中间体的加氢金属化途径。(方案2)。
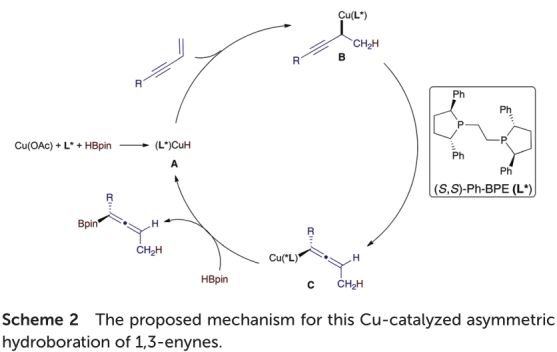 在手性配体存在下通过与HBpin反应激活Cu(OAc)生成手性Cu(I)-H物种A。1,3-烯炔中烯烃单元的对映选择性2,1-插入Cu-H物种形成炔丙基铜中间体B,然后异构化为烯丙基铜物种C。中间体C与频哪醇硼烷反应以释放烯丙基硼酸酯产物并再生具有催化活性的Cu(I)-H物种A。
在手性配体存在下通过与HBpin反应激活Cu(OAc)生成手性Cu(I)-H物种A。1,3-烯炔中烯烃单元的对映选择性2,1-插入Cu-H物种形成炔丙基铜中间体B,然后异构化为烯丙基铜物种C。中间体C与频哪醇硼烷反应以释放烯丙基硼酸酯产物并再生具有催化活性的Cu(I)-H物种A。
总之,作者开发了一种有效的方法,用于通过Cu(OAc)和(S,S)-Ph-BPE配体催化的1,3-炔烃与HBpin的不对称硼氢化来进行手性硼酸烯丙酯的对映选择性合成。一系列烷基和芳基取代的1,3-烯炔反应,得到良好分离的收率和高对映选择性的烯丙基硼酸酯产物。多种合成有用的功能与开发的反应条件兼容。对手性烯基硼酸酯的立体定向转化合成应用的研究将是未来研究的主题。
这篇关于169v 条目不存在_铜催化的频哪醇硼烷对1,3烯炔的不对称硼氢化反应获得手性烯丙基硼酸酯...的文章就介绍到这儿,希望我们推荐的文章对编程师们有所帮助!






