本文主要是介绍生物制品上市后变更的可比性研究,希望对大家解决编程问题提供一定的参考价值,需要的开发者们随着小编来一起学习吧!
《已上市生物制品药学变更研究技术指导原则(试行)》(国家药品监督管理局二0二一年六月)提到“开展变更可比性研究是生物制品上市后药学变更评价的基础和成功的关键。”“可比性验收标准不等于质量标准。”“对于定量检定项目,应运用适当的统计学工具来制订可比性验收标准。”
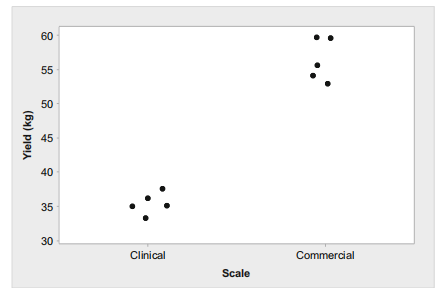
但是指导原则并没有提供具体实施案例。现在考虑工艺转移过程的可比性问题。变更前的数据来自于两个生产规模,即临床批次和商业批次。已获得生产许可的工厂将转移工艺到同样商业规模的不同生产工厂(即变更后的工厂),感兴趣的参数是受控工艺参数,产量,其标准为40.8–75.0 kg。变更前的数据如下表:
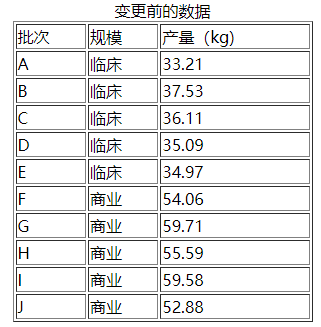
临床前批次n1=5,临床后批次n2=5。可以看出临床规模和商业规模的产量是不同的,但是数据的离散程度是相似的。
如何用这些数据为可比性研究提供标准呢?想知道答案吗?
这篇关于生物制品上市后变更的可比性研究的文章就介绍到这儿,希望我们推荐的文章对编程师们有所帮助!







