本文主要是介绍Microbiome | binning+转录组→首个草鱼肠道基因集目录发布啦,希望对大家解决编程问题提供一定的参考价值,需要的开发者们随着小编来一起学习吧!

草鱼便宜又好吃
但是你了解草鱼吗?
草鱼的肠道里定殖着成千上万的共生微生物,它们与草鱼共同生存,相互影响。这些微生物在草鱼的新陈代谢、免疫调节等方面发挥着重要作用。
虽然同为经济作物,鱼类的微生态相关研究远远不如于其他畜禽,经济鱼类的微生物基因目录也尚未构建。
近期,来自中国农业科学院饲料研究所的研究团队,在《Microbiome》上发表了题目为《Deciphering the gut microbiome of grass carp through multi-omics approach》的文章。文章结合宏基因组+binning+转录组的组学手段对草鱼肠道微生物群的结构和功能特征进行了研究,并构建了首个草鱼基因集目录。

研究团队通过对36个草鱼肠道样本进行宏基因组测序,一共获得476855093 reads,鉴定出575856个非冗余基因,成功构建了首个草鱼肠道基因目录。从门水平上看,50%以上注释结果属于变形菌门,其次是拟杆菌门、厚壁菌门和梭杆菌门。与哺乳动物相比,鱼类的肠道微生物功能存在偏差,微生物间相互作用的遗传能力较高,营养代谢的遗传能力较低。
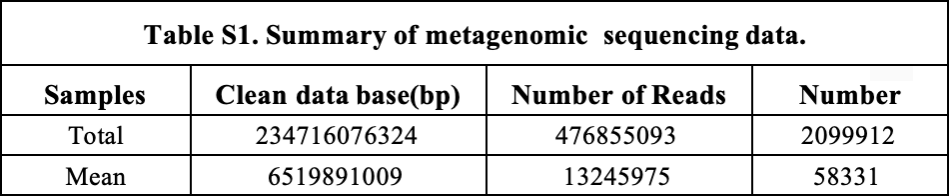
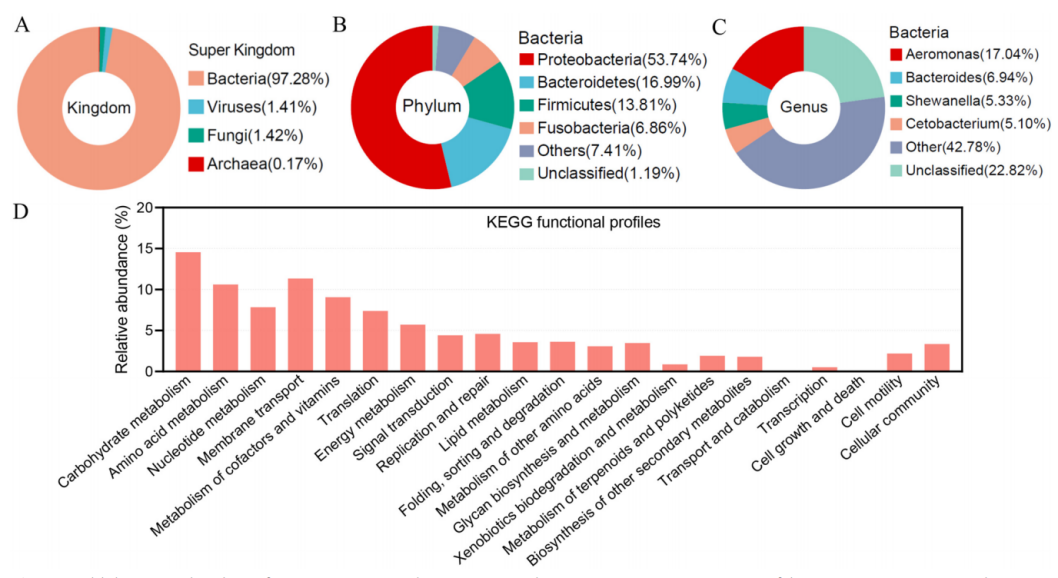
图 草鱼肠道微生物组基因目录的建立与分析
共发生网络分析发现变形菌门与梭菌门、厚壁菌门、拟杆菌门等菌群之间存在互斥的相互作用模式,这说明可以分为以变形菌门为核心属与后三者的核心属之间存在相互排斥的关系,从而可将草鱼肠道微生物分为两大类群。
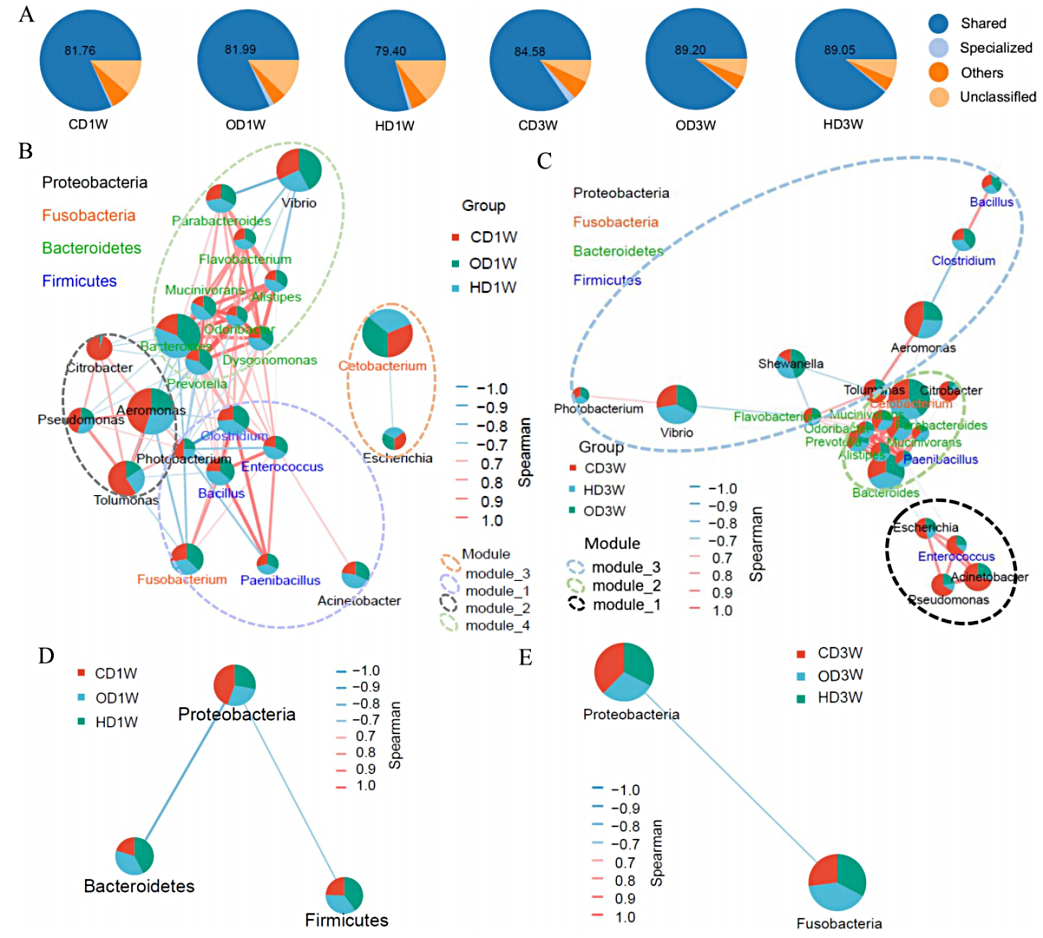
图 草鱼肠道微生物群核心菌属的共现网络分析
WGCNA分析以及对肠道菌群和宿主基因模块进行了相关性分析显示,可以发现在功能方面两个类群可以被认为是两个功能群,即功能群 1(变形菌门)和功能群 2(梭杆菌/厚壁菌/拟杆菌门),这两个功能群在碳水化合物利用、毒力因子和抗生素抗性的遗传能力等方面表现出明显差异。KEGG分析显示,与微生物群显著相关的肠道基因模块主要包括免疫系统识别微生物的功能(例如,Toll样受体信号通路、NOD样受体信号通路和RIG-I样受体信号通路)。在肝脏中,与微生物群有显著关联的基因模块涉及营养代谢功能(例如,丙酸代谢、脂肪酸代谢、脂肪酸生物合成和不饱和脂肪酸的生物合成)、免疫系统(例如,NOD样受体信号通路和RIG-I样受体信号通路)和内分泌系统(例如,PPAR信号通路和脂肪细胞因子信号通路)。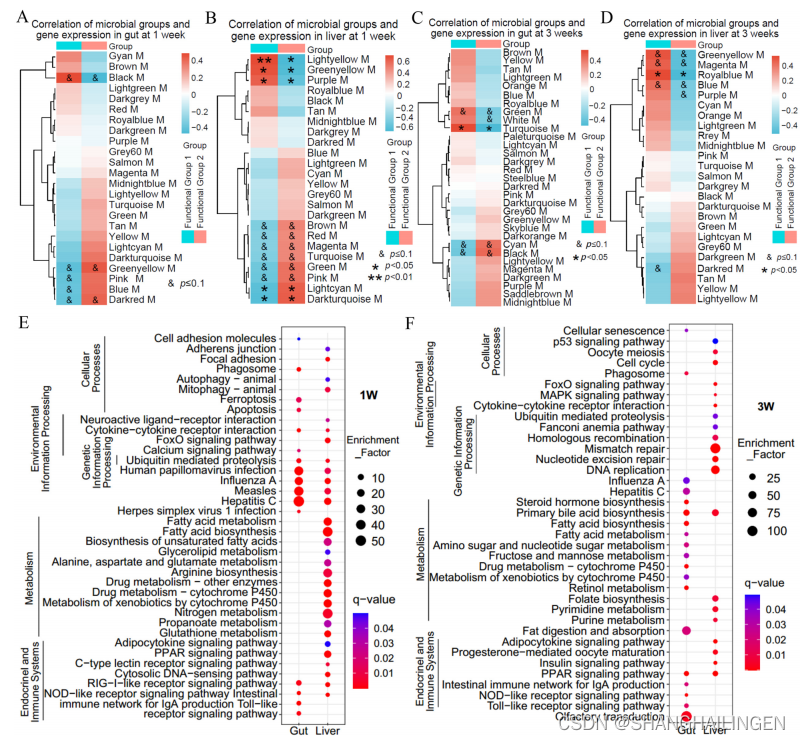
图 肠道微生物群与宿主基因模块相关性
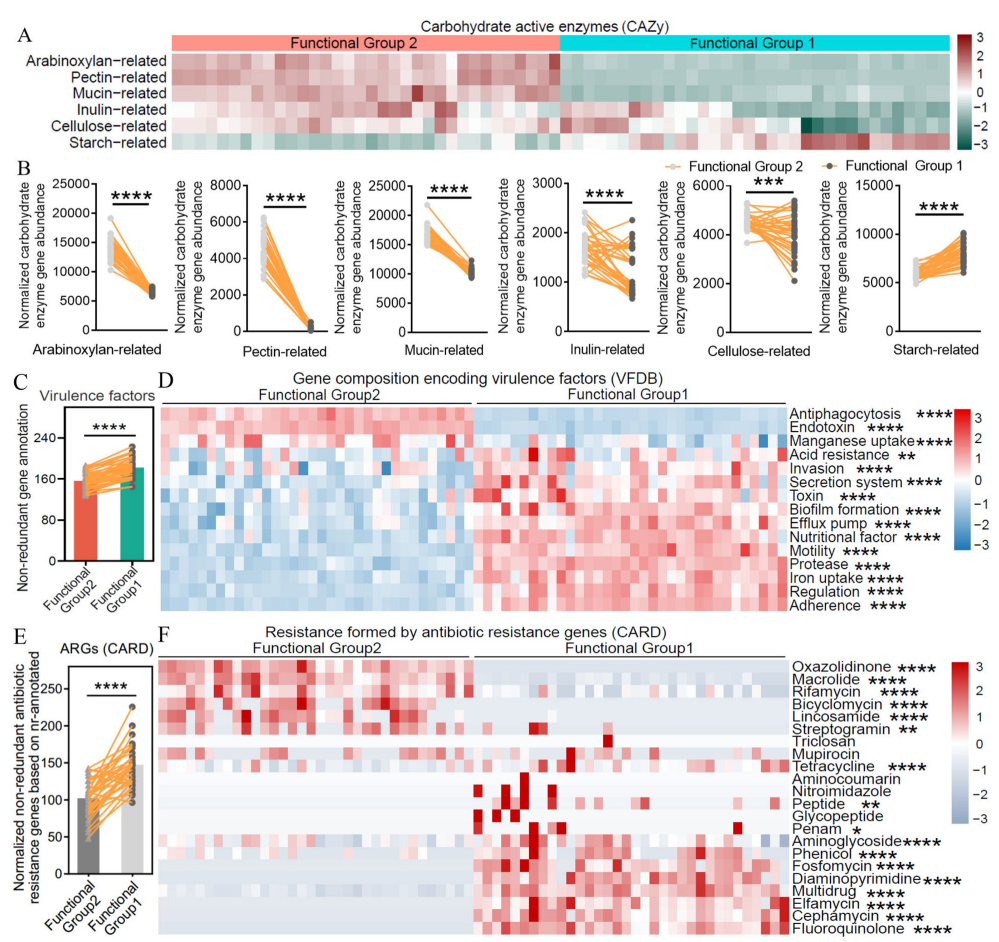
图 这两个功能群在碳水化合物利用、毒力因子和抗生素抗性方面的遗传能力不同
此外,研究还提出“功能群2/功能群1”的比值可以作为反映草鱼微生物群结构和功能特征的有效生物标志物评估草鱼肠道结构和功能特点,这为我们理解鱼类肠道生态提供了独特的视角。
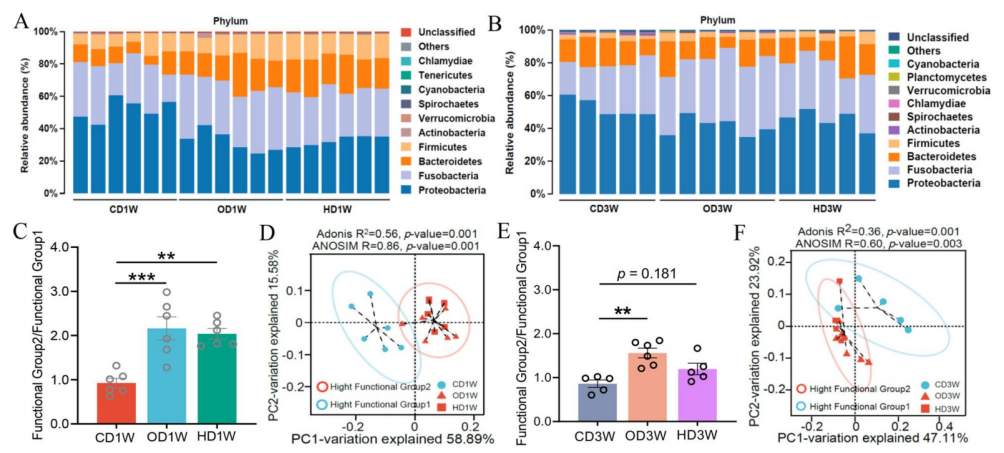
图 功能组 2/功能组 1 的比例反映了与不同饮食组的微生物群的结构差异
不同饮食组中,高比例组含有更丰富的编码用于生产醋酸盐的关键酶(FTHFS)的基因。观察到丁酸盐生产关键酶(Buk,AtoA/D)的类似趋势。这些结果表明,高比例组的微生物群在碳水化合物利用和SCFAs生产方面具有更高的能力。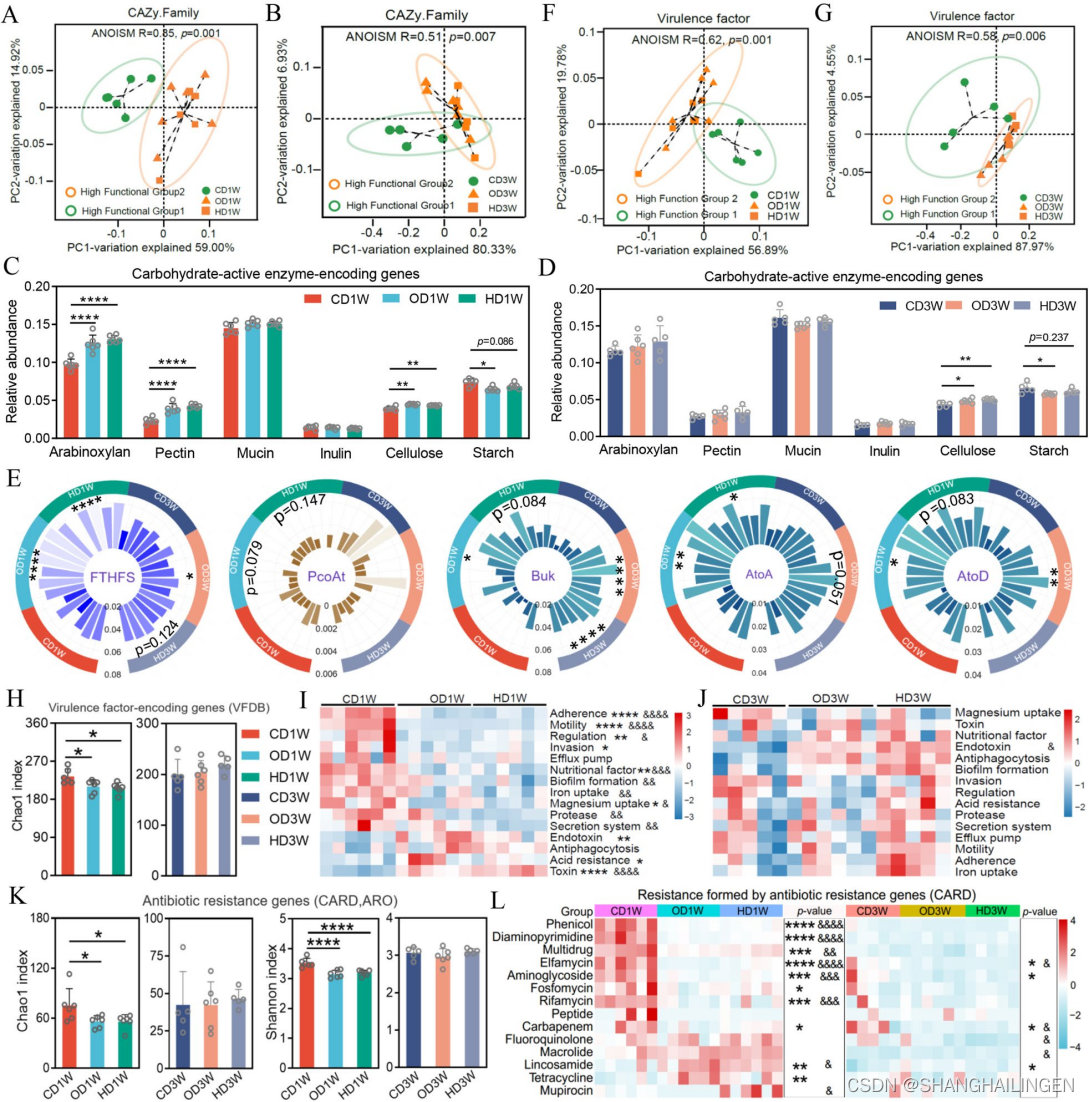
图 功能组2/功能组1的比例反映了微生物群的功能特征
此研究,不仅揭示了草鱼肠道微生物群的奥秘,也为水产养殖业的绿色发展提供了新的思路。可以通过调控草鱼肠道微生物群的结构和功能,改善草鱼的健康状况,提高养殖效率,减少抗生素的使用,实现水产养殖的绿色可持续发展。这不仅有助于解决当前水产养殖面临的种种挑战,还能为我们带来更加健康、美味的草鱼产品。
参考文献
Li M,Liang H,Yang H, et al. Deciphering the gut microbiome of grass carp through multi-omics approach. Microbiome. 2024
这篇关于Microbiome | binning+转录组→首个草鱼肠道基因集目录发布啦的文章就介绍到这儿,希望我们推荐的文章对编程师们有所帮助!






