本文主要是介绍JACS | MD揭示TetR中热点突变引起的多重别构调控机制,希望对大家解决编程问题提供一定的参考价值,需要的开发者们随着小编来一起学习吧!

别构效应(蛋白质上远程位点之间的长程通讯)对许多生物学功能至关重要,并有可能在药物开发和蛋白质工程等领域得到应用。热点残基对调控别构效应的程度起关键作用。作者利用广泛的分子动力学模拟研究了四环素抑制剂(TetR)的几个代表性热点突变体。发现TetR通过同位效应机制调控细菌中的抗生素抗性基因。
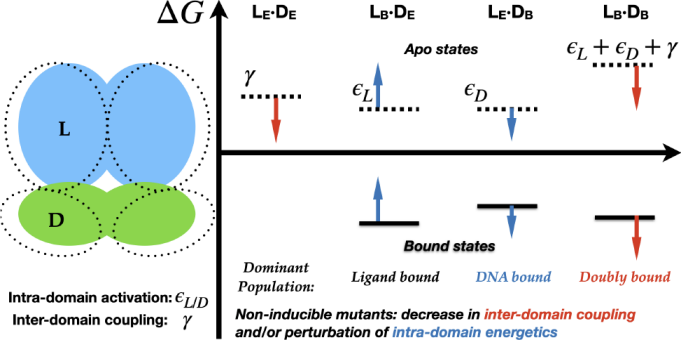
1. 模型搭建
构建野生型和多个代表性热点突变体(如G102D、R49A等)的分子模型。这些模型主要基于TetR的结晶结构(配体结合状态或DNA结合状态)并使用相应的坐标进行原子替换来引入突变。模拟多个功能状态:空态、配体结合状态和DNA结合状态。为了减少初始构象的局限性,每种状态通常从3个不同的初始构象开始模拟。此外,采用广泛的无偏模拟(达60微秒)和增强采样模拟相结合的策略。选择合适的集合变量(CV)以描述蛋白质的功效:例如DNA结合域间距来区分诱导和非诱导构象,反映DNA结合亲和力;配体结合口紧密性相关变量反映亲合力。
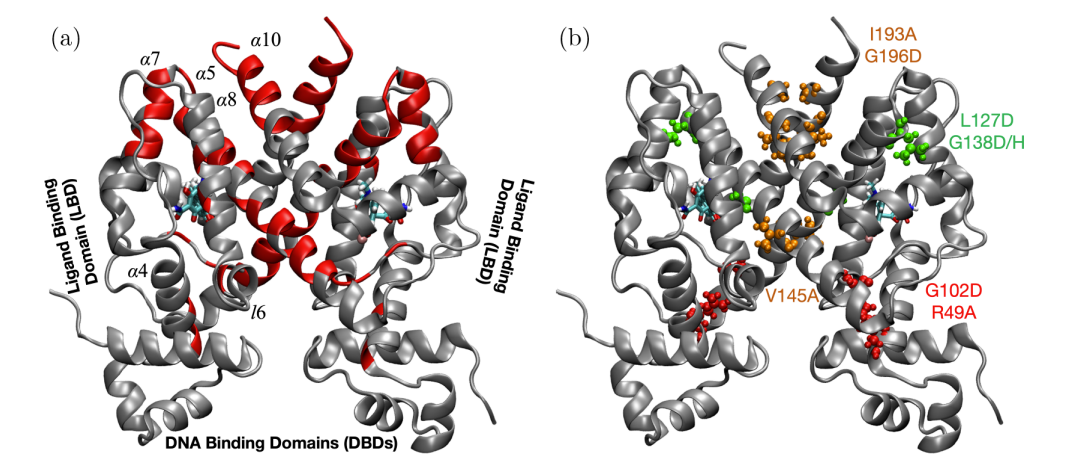
2. 结果
这些热点突变影响别构效应的两大关键因素:配体结合域和DNA结合域之间的相互作用(称为域间耦合),以及与配体结合相关的域内能量学性质。例如在G102D突变体中,引入的天冬氨酸与域界面上的几个阳离子残基形成新的相互作用,改变了域间耦合;而在R49A中,R49与野生型蛋白中的E157’的相互作用被破坏。在几个例子中如G102D,一个突变同时显著扰动这两类性质。
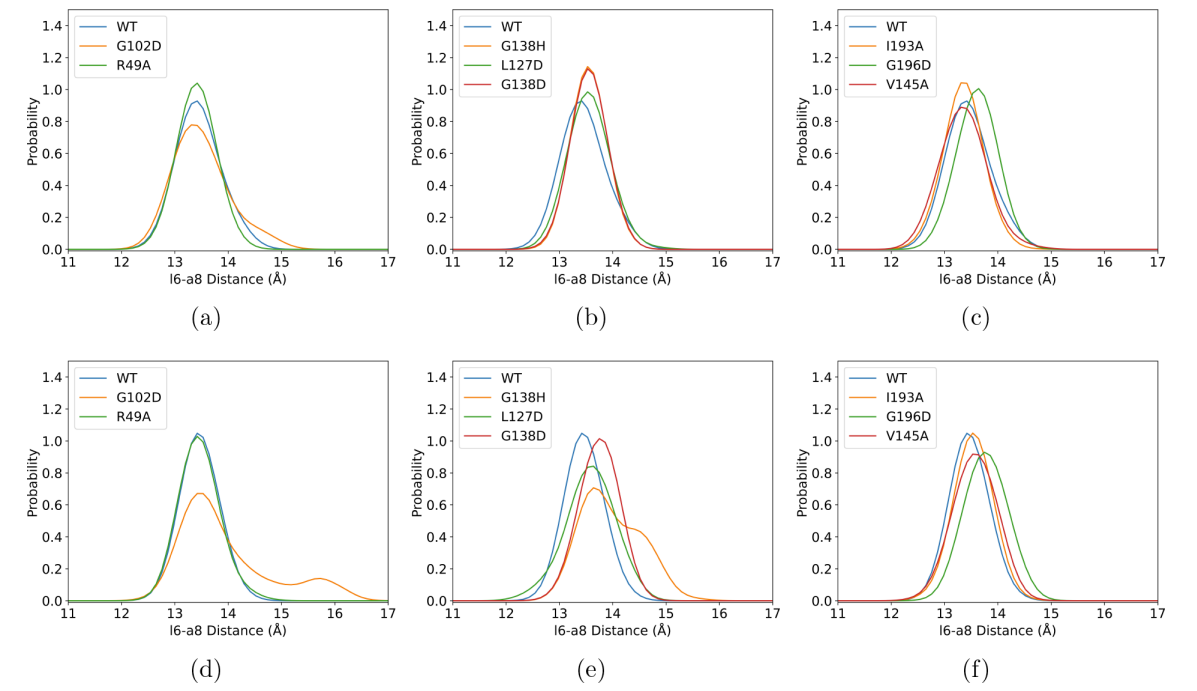
图1:元动力学模拟得到的配基结合态不同构象态的结合口袋距离分布
(a−c) in the “ligand-only basin”,(d−f) in the “doubly bound basin”
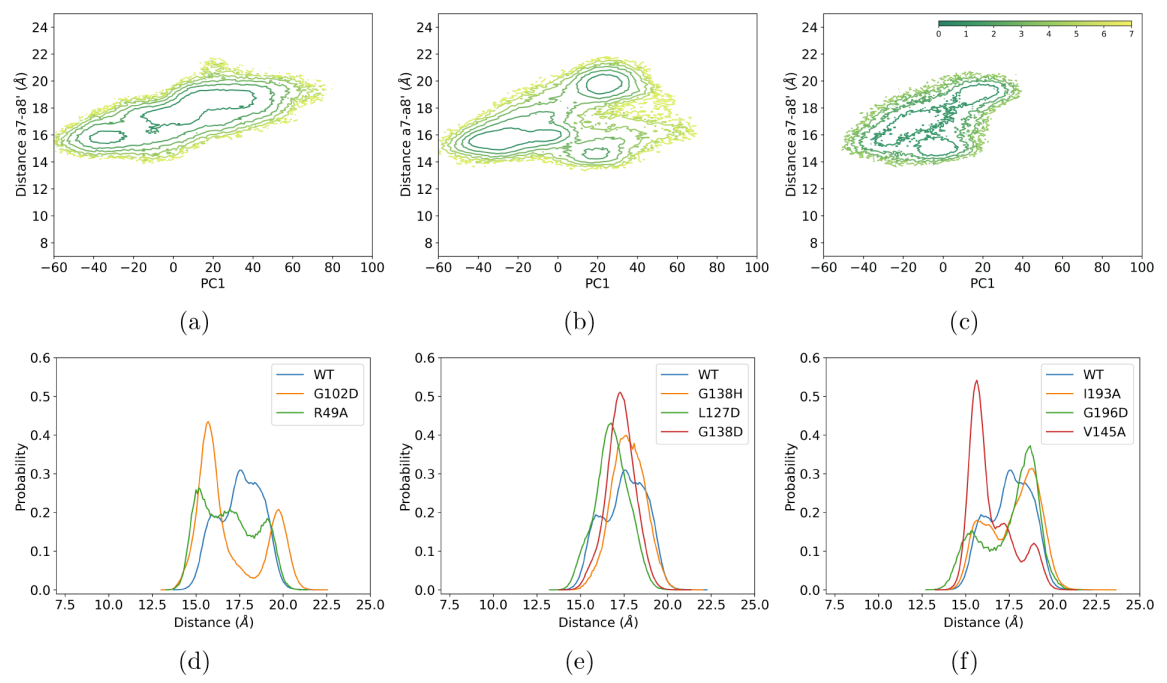
图2:apo状态自由能景观和配体结合口袋距离分布情况
实验观察到的相同的失活表型(非诱导表型,即四环素结合后仍然抑制基因表达),在不同的突变体中来源于蛋白质结构和能量特征的不同变化。例如在G102D中是由于域间耦合减弱;而在R49A中主要是配体结合区域构象集合变化从而降低表观亲和力。评估这些机制细节对调控同位效应尤为重要。
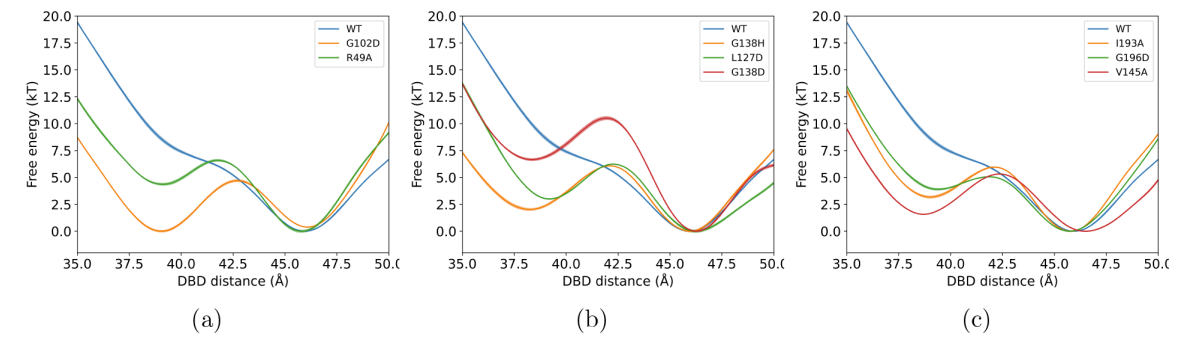
图3:基于元动力学模拟的DNA结合结构域(ligand-bound state)距离分离的平均力势(PMF)
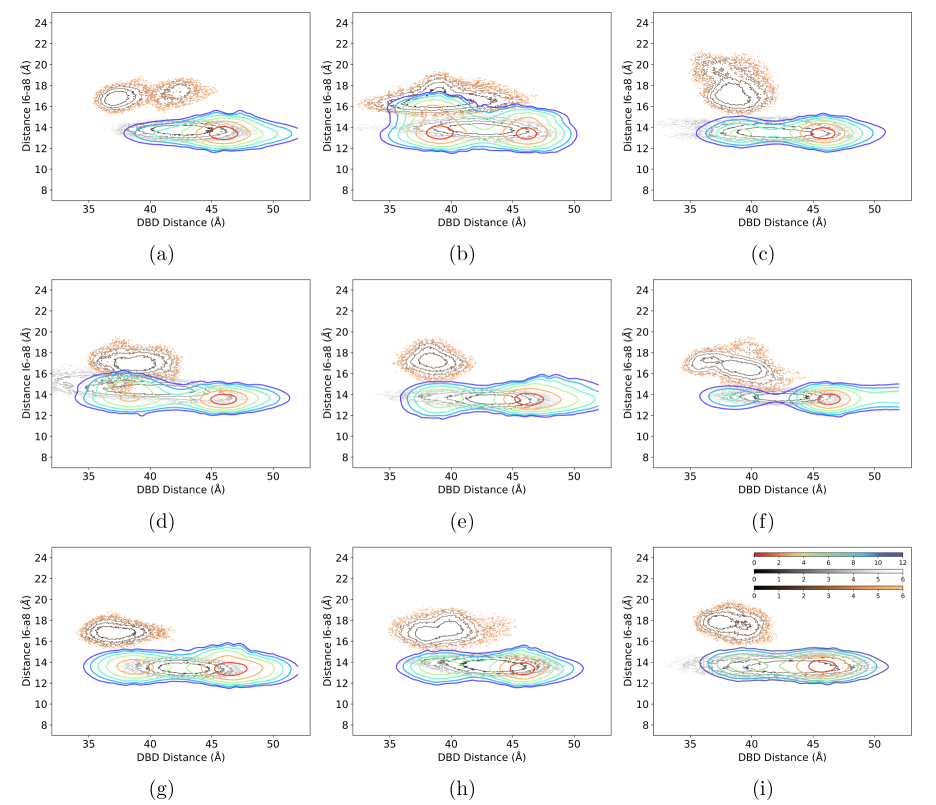
图4:DNA结合态和配基(DNA或ligand)结合态的二维自由能景观: (a) WT, (b) G102D, © R49A, (d) G138H, (e) L127D, (f) G138D, (g) V145A, (h) I193A, and (i) G196D. 配色方案:彩虹,配体结合态元动力学模拟; 灰色、无偏配体结合态模拟; 铜色、DNA 结合模拟
模拟结果与实验的可逆性结果总体一致:引起更大自由能面改变的突变如G102D难以逆转,而R49A和G196D的影响较小且较易被额外突变所补偿。这与Deep mutational scanning(DMS)实验结果的可逆性顺序(G102D < R49A < G196D)吻合。因此,功能自由能模拟可以评估热点残基的可逆性,为别构效应的调控提供定量指导。
总的来说,这项工作证明了运用分子模拟结合自由能计算来评估和比较别构效应系统中的热点突变的效用,这可以指导合理调控蛋白质的别构效应。
这篇关于JACS | MD揭示TetR中热点突变引起的多重别构调控机制的文章就介绍到这儿,希望我们推荐的文章对编程师们有所帮助!



