本文主要是介绍超详细!超柔纳米电子探针可形成可靠、无胶质瘢痕的神经整合,希望对大家解决编程问题提供一定的参考价值,需要的开发者们随着小编来一起学习吧!

微信公众号关注: 脑机接口研习社
关注脑机接口领域最新发展资讯
Abstract
侵入式脑电极是体内与单个神经元电接口的唯一手段,但是它们的记录效率和生物相容性使其在科学和临床应用中是有局限的。文章发现具有亚细胞尺寸、超柔韧性和细胞外科手术印记(cellular surgical footprints)的纳米电子线(nanoelectronic thread,NET)电极可形成可靠的、无胶质瘢痕的神经整合(glial scar–free neural integration)。研究者证明了NET电极可以在单个单元水平可靠地检测并跟踪数月之久,在长期植入过程中,NET的阻抗、噪声水平、单个单位的记录产量以及信号幅度均保持稳定。体内双光子成像和死后组织学分析显示,NET探针与局部细胞和脉管系统网络无缝地与亚细胞整合。
一、INTRODUCTION
长期植入的电极通过获取活体大脑中各个神经元的电活动,是最重要的神经技术之一。尽管有时会观察到长期电记录,但慢性记录容量有较大变化的情况常被报告,这主要是由于:无论是短期还是长期,常规电极和大脑组织之间的界面都缺乏稳定性。
常规的神经植入物的体积和手术印记远大于细胞和毛细血管,从而引起局部细胞和血管网络的实质性损伤和破坏。此外,这些探针比宿主脑组织的硬度明显更高,后者的自然微动会在界面处引起强烈的压力。
在短期内,电极从其目标神经元产生的位移会导致时间尺度上突然的波形变化,而时间尺度可能长达数小时之久,从而阻止了数天甚至更长时间内对单个神经元的可靠跟踪。
从长远来看,植入物的存在会引起反复的细胞和血管损伤,引起持续的炎症和组织反应,并最终导致植入物附近的神经元降解和神经胶质瘢痕形成。这些慢性恶化在电记录中表现为记录保真度的下降,包括阻抗增加、噪声水平升高、信号幅度下降和单位记录减少。
过去十年中的大量研究工作表明,减小神经探针的尺寸和刚性可以改善神经界面。
最近的工作表明,大孔电子器件和由碳纤维制成的超小型微电极大大降低了组织反应。
但是,可靠的脑探针能够长时间地检测和跟踪同一神经元的活动,并且需要没有上述任何慢性有害作用,因此需要无缝的生物整合,这些都尚待证明。
考虑到以前在改善神经电极界面方面的努力,我们确定了以下关键方面,以建立可靠且无胶质瘢痕的神经探针界面:
- 探针的尺寸与普通细胞和毛细管的尺寸相当或更小,因此对宿主生物基质的干扰极小探针的尺寸与普通细胞和毛细管的尺寸相当或更小,因此对宿主生物基质的干扰极小;
- 探针具有足够的灵活性,以确保完全顺应组织的微动,并将探针-组织的界面力降低到细胞力的范围(nanonewtons);
- 植入过程中的手术损伤小于ca. 100μm,以使组织得以恢复;
- 该探头具有机械和电气方面的坚固性,可在生理条件下长期发挥功能。
为了满足这些严格的要求,我们开发了超柔性纳米电子线(NET)脑探针以及具有细胞大小的手术脚印的植入策略。
我们通过长期的电记录和探针-组织界面的全面表征,验证了我们的方法在啮齿动物(小鼠)模型中的有效性。
二、Results
我们使用多层,无基板的结构和专门的光刻技术(材料和方法)设计和制造了两种类型的NET脑探头NET-50和NET-10。
如图1所示,NET-50具有四层布局,总厚度为1μm,平均宽度为50μm,具有八个电极的线性阵列。NET-10的横截面为10μm×1.5μm,据我们所知,这是在所有已报道的神经探针中最小的,其有七层,在两个相对的表面上容纳四个电极。
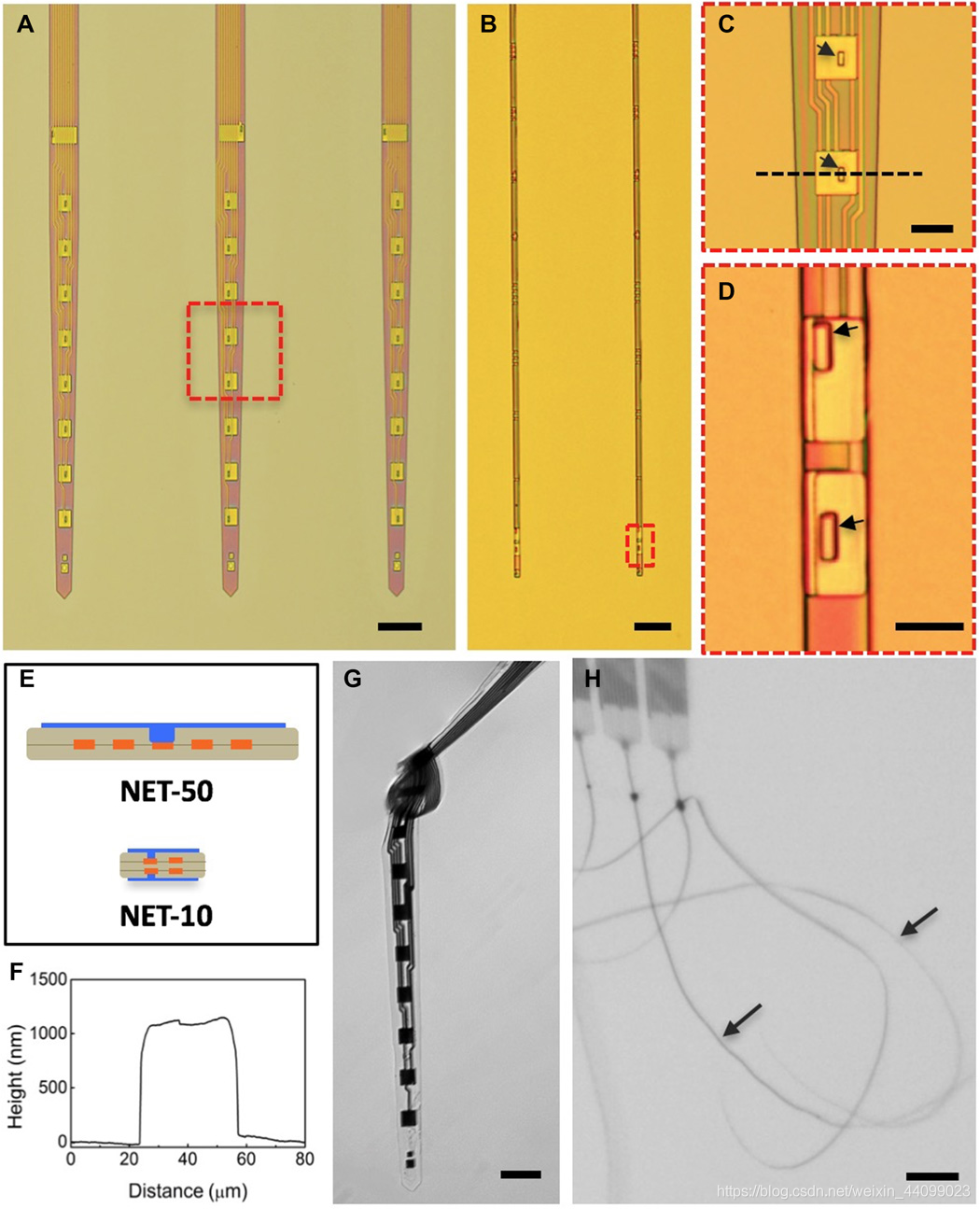
▲原文中的图1:NET神经探针的结构
A和B. 基板上的预制NET-50和NET-10探针。
C和D. 分别由(A)和(B)中的虚线框标记的两个电极的放大视图。箭头表示“vias(导通孔)”。
E.(A.顶部)和(B.底部)中探针横截面的示意图,突出了多层布局。颜色代码:灰色,绝缘;橙色,互连;蓝色,电极。没有按比例绘制。
F. NET-50探针通过原子力显微镜测得的沿(C)中虚线的高度轮廓。
G. NET-50探针悬浮在水中。打结的曲率小于50μm,以说明其柔韧性和耐用性。
H. 多个NET-10探针悬浮在水中。箭头表示探针。比例尺—100μm(A),50μm(B,G和H)和10μm(C和D)。
为了最小化体积和最大程度地提高灵活性,两种类型的电极和互连层均位于不同层上,这些层和互连层之间通过绝缘层的通孔进行电连接。
NET-50探针的设计类似于常用的硅神经探针(例如,NeuroNexus A8×8设计中的单个平板),而NET-10探针被设计为提供与四极体(tetrodes )相似的记录特性,两种探针的尺寸都大幅减小(图S1)。
与先前展示的神经探针相比,NET探针显着降低了有效弯曲刚度和每个电极的组织位移,从而显着提高了生物相容性(图S2)。
具体而言,弯曲刚度降低到了10^-15 N·m2个数量级,这将探针-组织的界面力降低到了纳米牛顿范围(图S3),与单细胞牵引力相当。
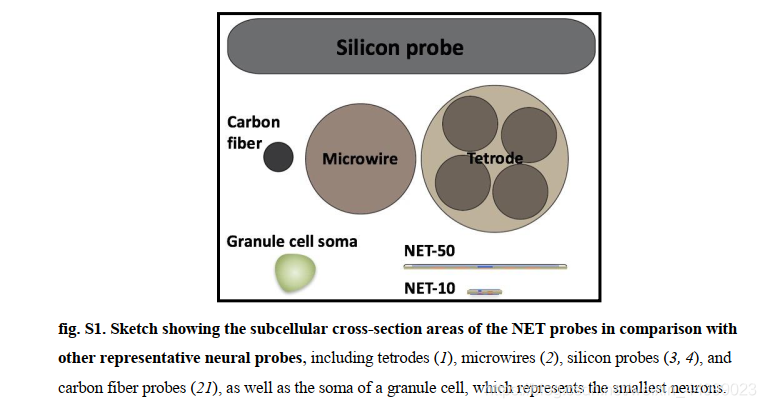
▲原文中的图S1
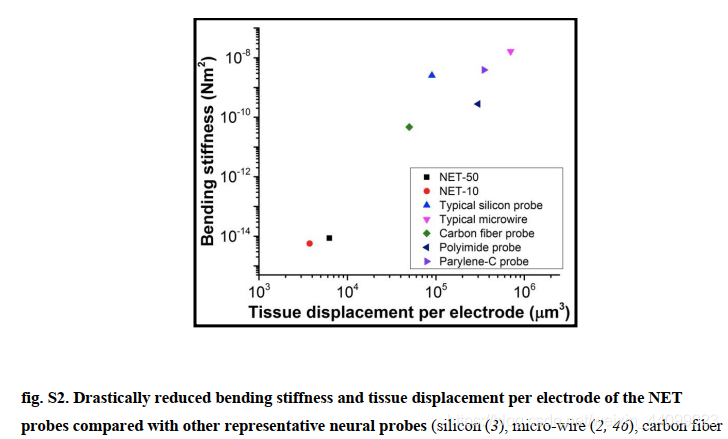
▲原文中的图S2
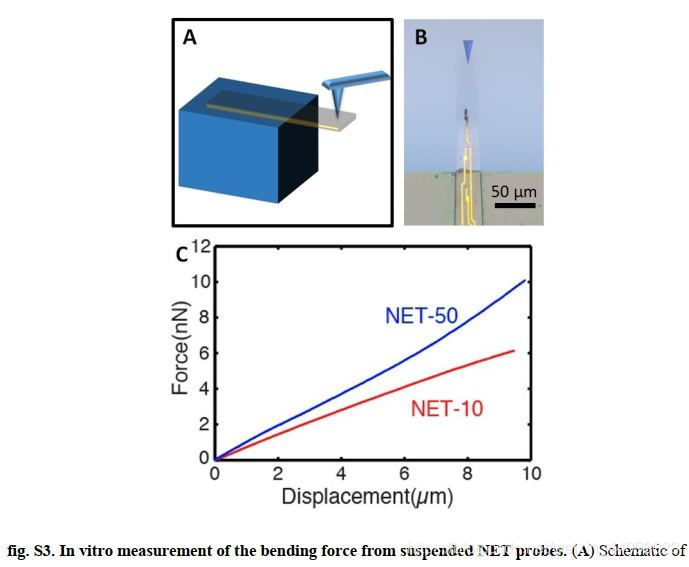
▲原文中的图S3
NET探针的超柔韧性从机械上排除了它们自支撑性穿透脑组织的能力。
以前提供柔性探针的策略包括临时更改探针的刚度,更常见的是将探针临时固定到刚性穿梭装置上。
但是,先前研究中使用的大多数穿梭装置的尺寸都大于100μm,远大于NET探针的尺寸,并导致无法恢复的损坏和持续的瘢痕形成。
通过使用临时接合机制(temporary engaging mechanism )(图2A)和由直径小至7μm的碳纤维和钨微丝制成的穿梭装置,我们将植入占位面积减小了约10倍,达到了细胞尺寸(图2B)。

▲原文中的图2:NET探针的植入程序
A. 示意图,显示了临时接合机制。箭头表示植入物的进入位置(实线),穿梭装置的输送路径(灰色)和啮合的NET探针的路径(虚线)。
插图:虚线正方形的放大图,突出显示了微柱与穿梭装置末端的NET探针上的微孔啮合。
B. 安装在微操纵器末端的直径为7μm,长度为3
mm的典型碳纤维穿梭装置的照片。比例尺,500μm。插图:穿梭装置尖端处直径为2μm,高度为5μm的微磨柱的扫描电子显微镜(SEM)图像。比例尺,2μm。
C. 光学显微照片,显示NET-50(顶部)和NET-10(底部)探针中的接合孔,其直径略大于柱子的直径,如箭头所示。
D和E. NET-50和NET-10探针(绿色)的伪彩色SEM图像(绿色),该探针附着在带有20μm钨微丝(D,紫色)和10μm碳纤维(E,紫色)的穿梭设备上
显示它们的超小尺寸。比例尺,50μm(D)和20μm(E)。
F和G. 显微照片显示NET-50和NET-10探针均成功地递送到了活的小鼠大脑中,而对急性组织的损害最小。箭头表示传导入口站点。比例尺为100μm(F)和50μm(G)。
H. 颅骨固定示意图,可容纳神经探针的连接器和允许光学进入的玻璃窗。没有按比例绘制。
I. 典型的手术后鼠的照片,该鼠带有植入的NET探针和安装在顶部的玻璃窗。插图:顶部,安装在头骨上的电缆连接器的图像;玻璃窗的底部放大图,其中箭头表示植入的探针。
J. 由植入的NET-50探针上的八个电极记录的典型单位活动。应用了高通滤波器(300 Hz)。
通过使用聚焦离子束(focused ion beam, FIB)制造的每个穿梭装置末端的微柱,可以实现接合机制(图S4)。在传导过程中,微柱插入微孔中(图2,C至E),并将NET探针拉至所需深度(图S1),然后穿梭装置脱离并缩回(材料和方法)。整个插入占用空间小至跨度为ca. 10μm(图2,D和E),仅导致细胞大小的手术损伤,正如如出血少(图2,F和G)和插入力小(图S4)所证明的。
利用超柔韧性和超小尺寸,我们通过NET植入物适应了慢性光学通路(chronic optical access)(图2,H和I),从而可以通过体内两光子(2P)成像来监视组织-探针界面。在整个手术过程中都保持了电气完整性,植入的电极很容易检测到单位活动(图2J)。
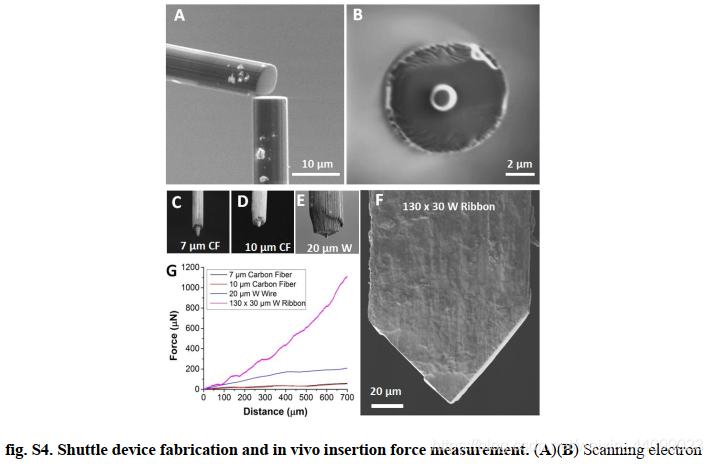
▲原文中的图S4
我们接下来评估了 NET 探针的长期可靠性。
我们将 16 个探针植入 7 只小鼠的体感和视觉皮层,共包含 96 个连接电极中的 80 个(83.3% 的制造良率)。
我们每月对麻醉动物进行两次电记录,持续了 4 个月。我们观察到记录性能在最初的 1.5 个月内有所改善,然后在以下方面保持稳定至少另外 2.5 个月(直到我们的实验期结束)。
首先,所有 80 个电极的平均阻抗和噪声水平在前 1.5 个月内下降并保持稳定(图 3A)。
其次,检测单元事件和可排序的单单元动作电位 (AP) 的电极数量在前 1.5 个月增加,然后保持在同一水平(图 3B;单元活动的示例包括不可排序的尖峰和可排序的单个单元 AP(sortable single-unit action potentials, AP: action potentials) 的单元活动的示例在图 S5 中详细说明)。多单元 (~75%) 和可排序的单个单元记录 (~25%) 的产量与用于麻醉下自发测量的传统硅探针相当 ,但具有前所未有的慢性稳定性(chronic stability)。
最后,我们检测到来自 19 个电极的可排序 AP 波形,平均振幅和信噪比 (SNR) 在整个 4 个月期间保持稳定(图 3C)。
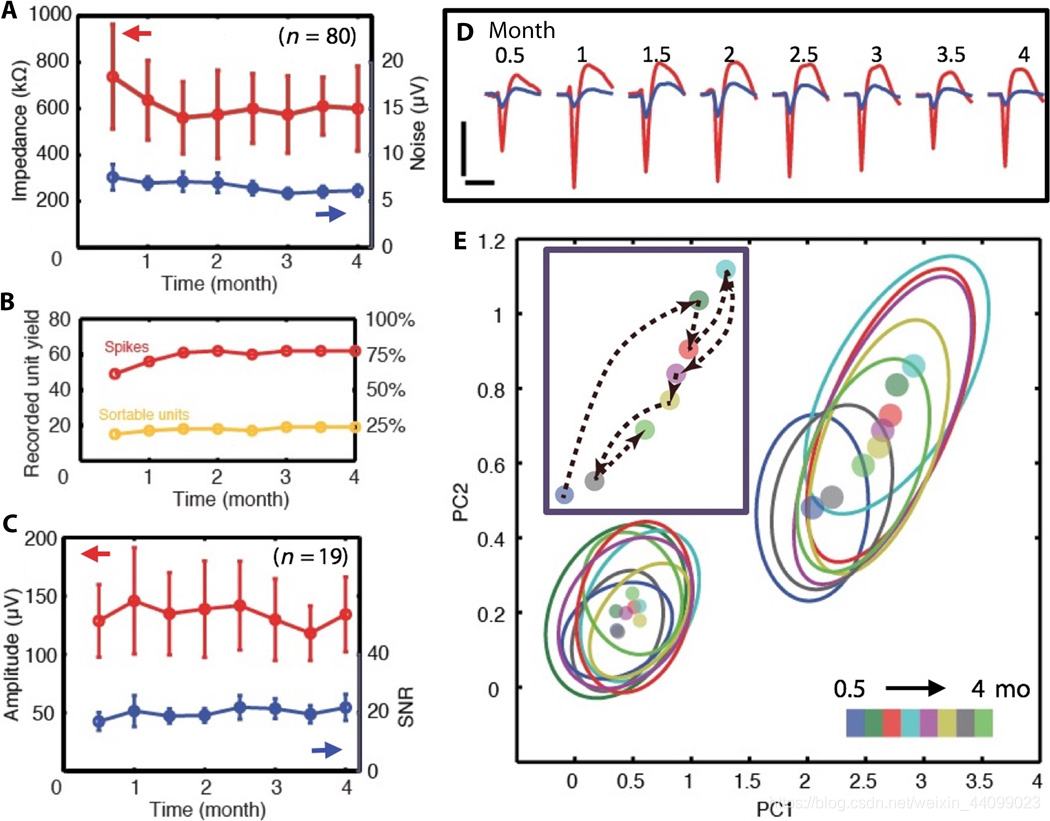
▲原文中的图 3:植入的 NET 电极的慢性记录和电特性
A. 作为时间函数的 80 个植入电极的阻抗(红色)和噪声水平(蓝色)。误差线标记 SD.
B. 记录单位活动(红色)和可排序的单个单位AP(橙色)作为时间函数的电极数量(左)和百分比(右)。
C. n = 19 个电极作为时间函数记录的单个单元 AP的平均峰谷振幅(红色)和 SNR(蓝色)。误差线表示 SD。
D. 一个电极在 4个月内每月两次测量,记录了不可排序的的尖峰(蓝色)和可排序的的 AP 波形(红色)。 波形是从 3 到 9 分钟的记录段中隔离和平均的。竖条: 200 μV;横条: 1 毫秒。
E. (D) 的所有波形的主成分 (PC) 分析。 点:PC 的中心。椭圆:PC 分布的 2σ 轮廓。颜色: 编码时间戳。
插图:单个单元波形的 PC 中心随时间的演变。
我们跟踪了所有 80 个电极 4 个月,并在表 S1 和图 S5中总结了它们随时间推移的动物和探针特异性性能。
尽管不同动物的功能电极数量和单位检测率存在差异,但在所有动物中均观察到单位检测随时间的稳定性和一致性。
例如,图 3D 显示了来自电极的两个月的测量值,该电极检测到典型的尖峰事件和所有电极中具有最高 SNR (>30) 的可分排序AP 波形。可排序 AP 波形的持续高 SNR 表明放电神经元在慢性记录的整个持续时间内都保持靠近电极。所有测量的组合主成分分析显示,簇中心的平均位置偏移在连续测量之间有很大程度的重叠,相当于平均簇分布的 0.88σ(图 3E),表明波形是由同一神经元生成的。此外,我们反复检测到来自一个电极的中间神经元波形(图 S6),这是罕见事件(<10%),并作为跟踪同一神经元的高概率标记。
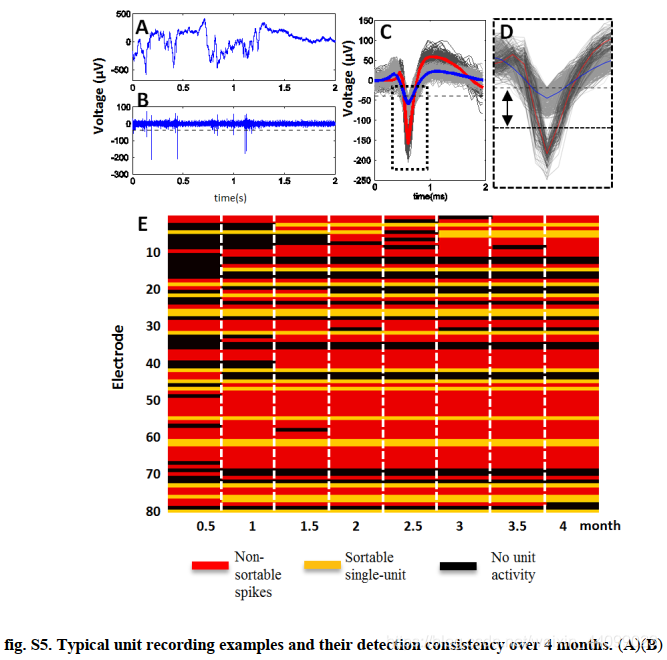
▲原文中的图S5
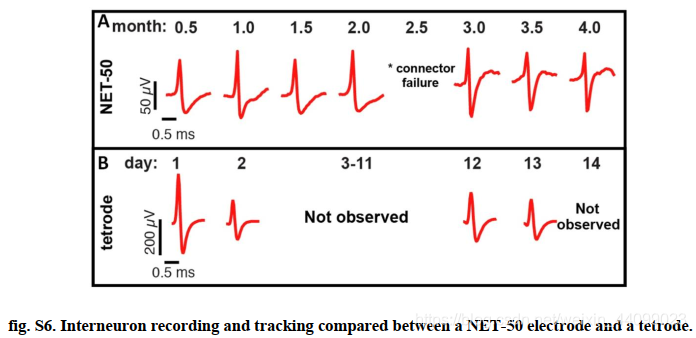
▲原文中的图S6
此外,我们观察到 AP 波形的持续特征,而除一个电极外,所有电极都发生了微小的可追踪变化(19 个中的 18 个,94.7%;图 S7)。
值得注意的是,与以前通常观察到振幅随时间减小的神经元探针相比,大多数 NET 电极记录的 AP 波形具有峰谷振幅的非单调变化(nonmonotonic changes in peak-valley amplitude)。
证据强烈表明 NET 探针与神经元形成了一个非降解的、缓慢进化的界面。
为了直接研究探针-组织界面的性质,我们在手术后长达 3.5 个月内,通过在植入部位的体内 2P 成像监测了 NET 探针周围的毛细血管、星形胶质细胞和神经元(材料和方法)。
图 S8 显示了血管系统的演变,表明手术损伤导致植入后血脑屏障 (blood-brain barrier, BBB) 的轻微局部渗漏,持续最多 1 个月,并随着血管重塑而完全修复。
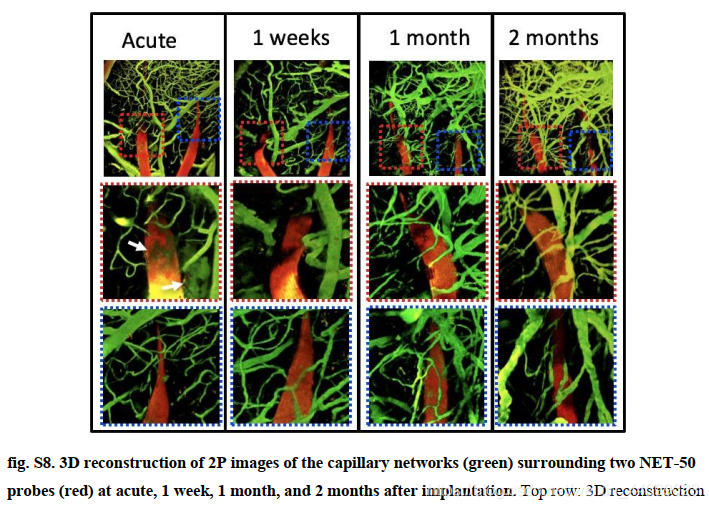
▲原文中的图S8
如图 4(A 和 B)和图 S2 所示,两种类型的 NET 探针都嵌入毛细血管中, 2 个月中毛细血管一直具有正常密度、形态和完整的 BBB 。我们通过线扫描( line scans )(图 4的C 和 D) 测量了血液流速,并在 (420 ± 180 μm/s) 附近和远离 (450 ± 210 μm/s) 探头(材料 和方法),确认紧邻探头的毛细血管灌注正常。这与传统微电极形成强烈对比,传统微电极在界面的慢性体内成像中观察到连续的 BBB 泄漏。
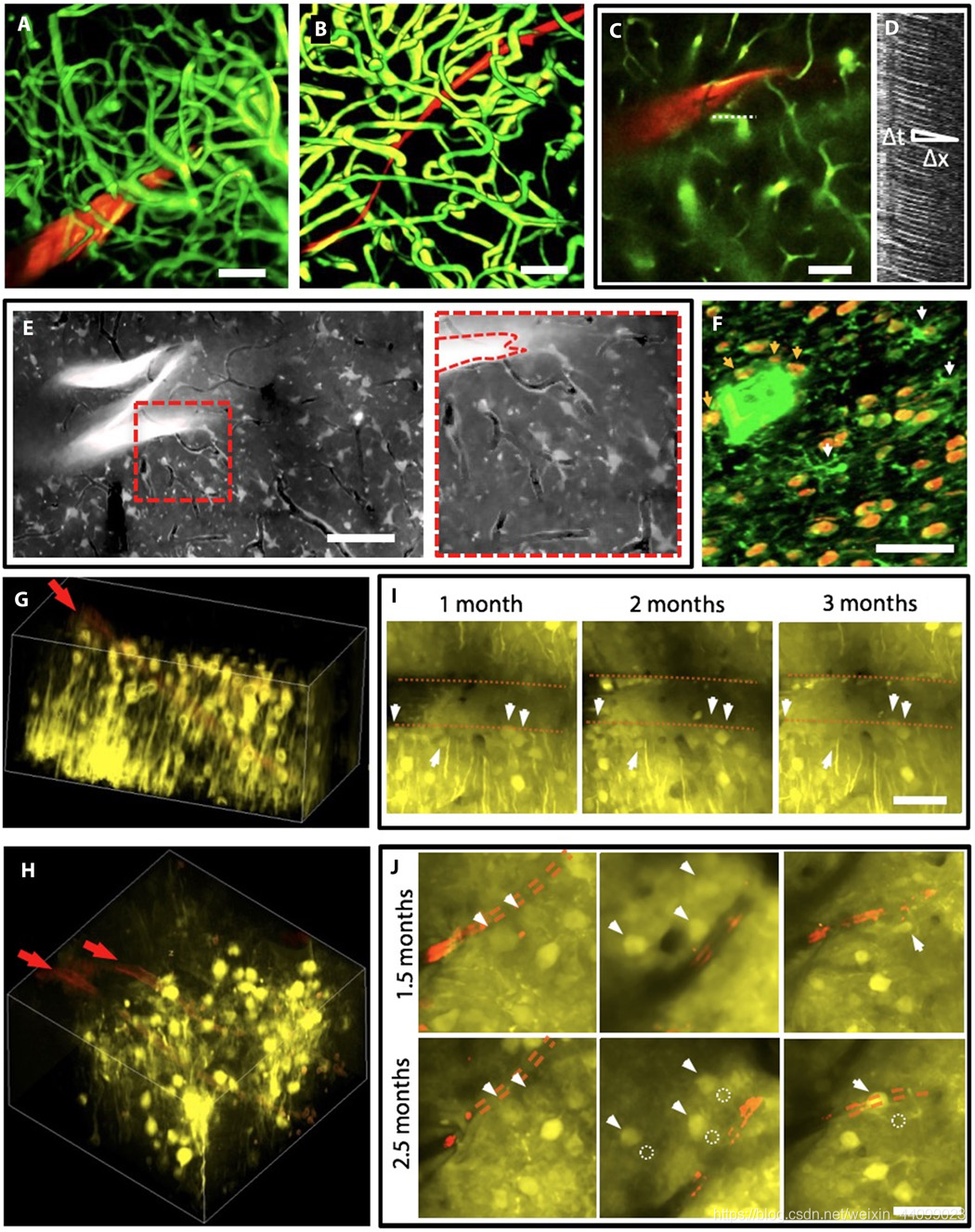
▲原文中的图 4:慢性探针-组织界面处细胞和血管结构的成像和跟踪
A和B. 植入后 2 个月,通过体内 2P 显微镜围绕 NET-50(A)和 NET-10(B)探针(红色)对血管系统进行三维(3D)重建,突出显示完全恢复的毛细血管网络(绿色)。
图像堆栈:大脑表面下方 0 到 400 μm (A) 和 100 到 320 μm (B)。有关 (B) 的完整视图,请参阅图 S2。
C. 200 μm 深的 2P 图像标记了 (D) 中线扫描的毛细管(虚线)的位置。
D. 线扫描矩阵显示红细胞的运动为暗条纹,其斜率给出了血流速度。
E. 植入后 3.5 个月脑表面以下 210 至 250 μm 的体内 2P 图像的投影,显示正常的星形胶质细胞和毛细血管。明亮的“z”形物体是一个折叠的 NET-50 探头。毛细血管可见为黑线。右图:虚线区域的放大视图。有关大脑表面下方 125 到 360 μm 的完整图像堆栈,请参阅图 S3。
F. 免疫化学标记的横截面切片(30 μm 厚,植入后 5 个月)的共聚焦显微照片的投影。伪色代码(False-color code):橙色,NeuN,标记神经元核;绿色,lba-1 标记小胶质细胞。白色箭头表示小胶质细胞体。橙色箭头表示与 NET 探针接触的神经元。
G和H. 植入后 2 个月和 2.5 个月,分别在 NET-50 探针 (G) 和两个 NET-10 探针 (H) 周围的 Thy1-YFP 小鼠中神经元(黄色)的体内 2P 图像的 3D 重建。探针为红色并用箭头表示。
成像深度:(G)脑表面以下 130 至 330 μm,(H)脑表面以下 110 至 260 μm。
I和J. 分别来自 (G) 和 (H) 中相同区域的代表性 2P 图像,显示神经元在植入后的不同时间被重复识别。红色虚线标记探针的边缘。箭头和虚线圆圈分别突出显示神经元的当前位置和先前位置。
有关完整的图像堆栈,请参阅图 S4 和 S5。
所有比例尺为50 μm。
我们在植入 NET-50 探针后 3.5 个月通过体内染色(材料和方法)对星形胶质细胞进行成像(图 4E 和图 S3)。
我们注意到,成像部分在植入过程中无意折叠,曲率低于 100 微米,这设定了 NET 探针的组织探针应力上限。我们观察到探针附近的星形胶质细胞仅包围具有正常密度和形态的毛细血管(类似于图 S9 中所示来自同一只小鼠的对侧半球的星形胶质细胞)。
我们还在植入后 5 个月进行了尸检组织学(材料和方法),并观察了探针附近的正常神经元密度(图 S10A)和静息小胶质细胞(图 4F)。
值得注意的是,与探针的直接接触不会影响神经元的活力,也不会激活小胶质细胞(图 4F)。
这些结果表明NET 探针具有前所未有的生物相容性,因为它们保持正常的血管和细胞结构,并且在界面处不会引起可观察到的慢性组织反应。
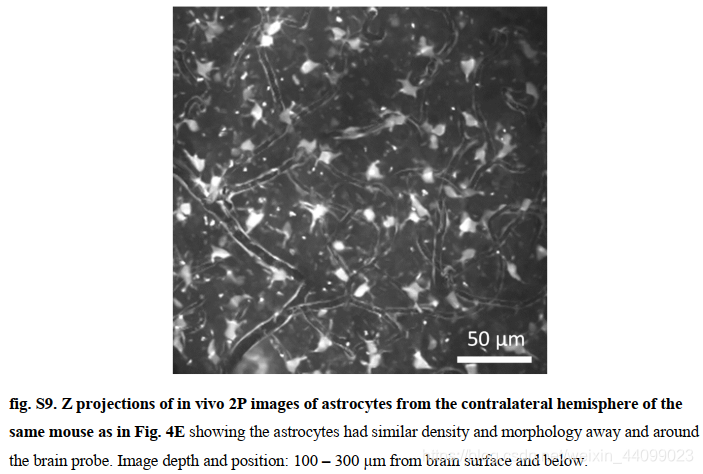
▲原文中的图S9
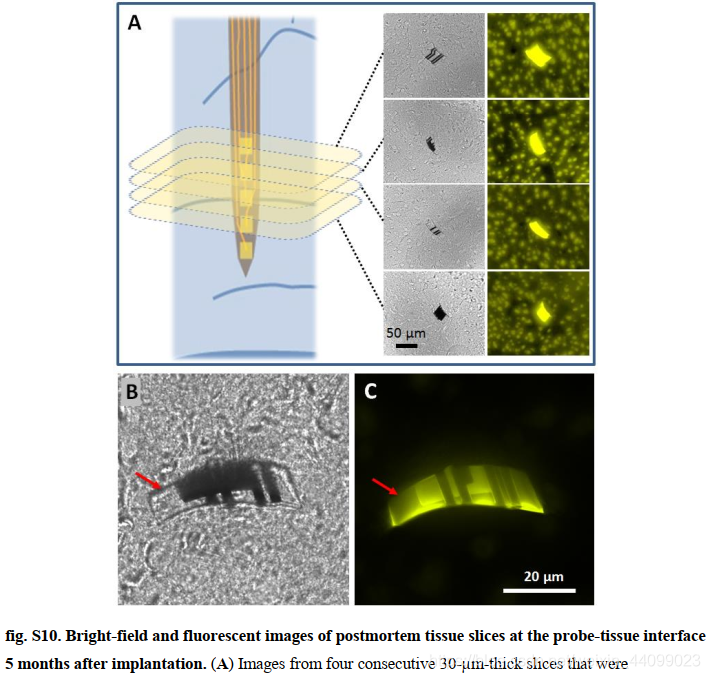
▲原文中的图S10
为了揭示神经接口的演变,我们在植入后长达 3 个月内反复对两种类型的 NET 探针附近的神经元进行成像,并将它们相对于一些代表性神经元和毛细血管的位置作为位置标记进行比较(图S4 和 图S5 、图4的G—J)。
我们观察到最初在探针附近成像的所有神经元都在后来的成像会话中被识别出来,这进一步证明 NET 探针不会引起慢性神经元丢失。
此外,尽管大多数神经元是相对静止的,但有些神经元在几周的过程中表现出缓慢的迁移(高达约 10 μm)(图 4:I 和 J)。值得注意的是,我们观察到它们的迁移轨迹没有偏向于移向或远离 NET 探针。
参考文献
Luan, L. , Wei, X. , Zhao, Z. , Siegel, J. J. , Potnis, O. , & Tuppen, C. A. , et al. (2017). Ultraflexible nanoelectronic probes form reliable, glial scar–free neural integration. Science Advances, 3(2), e1601966.
图源/百度图片


这篇关于超详细!超柔纳米电子探针可形成可靠、无胶质瘢痕的神经整合的文章就介绍到这儿,希望我们推荐的文章对编程师们有所帮助!










