本文主要是介绍用access将两个表合成一个表_北大深研院黄湧课题组Angew:卡宾催化连续手性中心的一步构筑及含氟羧酸衍生物的合成...,希望对大家解决编程问题提供一定的参考价值,需要的开发者们随着小编来一起学习吧!

 研究背景
研究背景 含氟化合物在医药和农业领域中应用非常广泛,通过对储量丰富的含碳碳双键的化合物的直接氢氟化反应制备含氟化合物是较为常用的方法。已报道文献中多利用金属氢化物或胺类分子作为催化剂催化该反应的进行(图1A-B),但需通过操作繁琐的分步反应来实现。因此发展一步法实现氢氟化反应的合成策略是非常必要的。
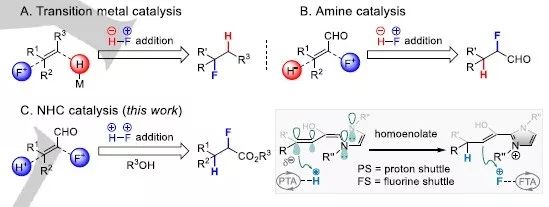
图1 碳碳双键的不对称氢氟化反应。
利用氮杂环卡宾(NHC)催化在氧化还原中性条件下的不对称质子化反应制备手性β-双取代羧酸衍生物是一种广泛使用的合成方法。此前黄湧课题组利用手性氮杂环卡宾或手性磷酸分子催化β-双取代烯醛化合物的不对称质子化反应合成了一系列β-手性分子如酰胺、酰肼和酯类等。但这些化合物的α位均为非手性的。因此,实现同时引入两个相邻的手性中心(其中一个为含氟手性中心)是非常具有挑战性的研究课题。
从机理方面考虑,同步实现β-质子化与α-氟化面临如下挑战:(1)两种亲电试剂H+与F+对高烯醇化合物β碳的竞争。(2)中间体acyl azolium的酯化反应与α-氟化反应的竞争。(3)高烯醇化合物的氧化或β-氟化等副反应的发生。
 成果简介
成果简介 针对上述问题,北京大学深圳研究生院的黄湧教授与陈杰安副研究员(共同通讯作者)在Angewandte Chemie International Edition上发表了题为“Enantio- and diastereoselective hydrofluorination of enals via N-heterocyclic carbene catalysis”的论文。该工作提出了在氧化还原中性的条件下通过氢正-氟正(H+-F+)的串联反应模式一步实现烯醛化合物的不对称氢氟化反应制备α,β-不对称含氟羧酸衍生物(图1C)。通过引入适合的质子化及氟化试剂和NHC催化剂来精确地调控β-质子化-α-氟化反应的动力学平衡,实现了具有连续不对称中心的α,β-含氟羧酸衍生物的普适性合成。
 研究亮点
研究亮点 该工作利用氮杂环卡宾催化烯醛化合物的连续不对称β-质子化-α-氟化反应,烯醛化合物与卡宾形成的高烯醇化合物的两个亲核位点依次被质子化和氟化。该催化体系可以以完整的化学选择性、非对映选择性及对映选择性得到各种结构的含氟羧酸衍生物。
 图文导读
图文导读 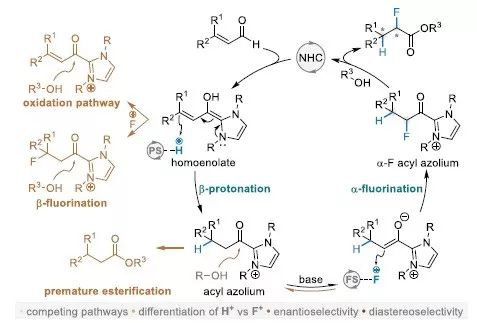
图2 氮杂环卡宾介导的高烯醇化合物中间体的不对称氢氟化反应的可能反应路径。
该工作涉及的反应路径(图2)为:烯醛化合物与NHC形成高烯醇化合物,之后经过质子化反应形成中间体acyl azolium,该中间体依次进行氟化反应与酯化反应。在这一过程中涉及几种副反应:(1)高烯醇化合物的直接氧化反应;(2)烯醇化合物的β-氟化反应;(3)中间体acyl azolium的酯化反应。
表1 肉桂醛的氢氟化反应条件优化。
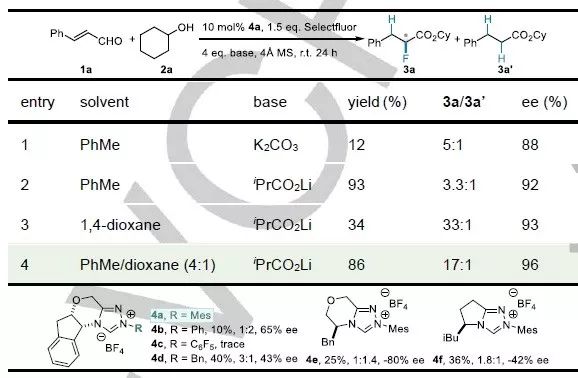
该工作首先选择肉桂醛作为反应底物来研究其α-氟化反应。条件筛选实验表明在非极性溶剂中溶解度较低的氟试剂(Selectfluor)可以有效抑制高烯醇化合物的直接氧化及β-氟化副反应;大的二级醇如环己醇(2a)有利于α-氟化反应的进行;异丁酸锂可作为质子供体与相转移催化剂来促进β-质子化反应的进行;甲苯与1,4-二氧六环的混合溶剂是该反应的最佳溶剂(表1,第4行)。
表2 β-芳基取代烯醛化合物的对映选择性氢氟化反应底物拓展。
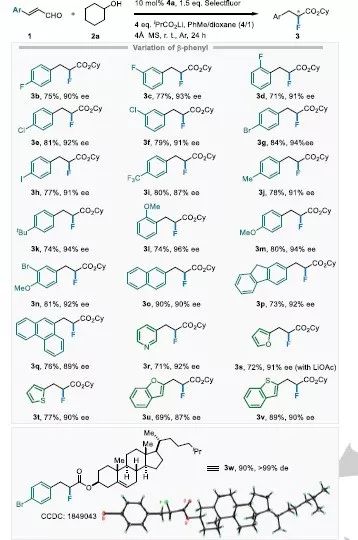
接着进行了β-芳基取代的烯醛化合物的氢氟化反应的底物普适性研究。不论苯环上含有缺电子还是给电子基团,这些化合物均可被选择性地转化为相应的产物(表2,3a-3n)。值得注意的是对于苯环邻位取代的肉桂醛底物,其产率稍微有所降低(3d,3l)。此外,该体系对于含有稠环和杂环的底物也可以顺利将其转化为目标产物(3o-3v)。当用胆固醇替换环己醇时也具有高的产率与非对映选择性(3w)。
表3 β-烃基取代烯醛化合物的对映选择性氢氟化反应的条件优化与底物拓展。
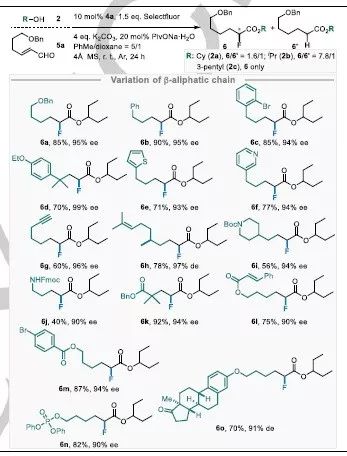
该工作还将底物范围拓展至β-烷基取代的烯醛化合物,并在优化的实验条件下(碳酸钾与20 mol%戊酸钠、3-戊醇)进行了底物拓展,由表3可以看到各种底物均可以被选择性地转化为目标产物(6d-n)。此外该催化体系还可以合成在医药中广泛使用的雌激素酮(6o)。
表4 β-甲基肉桂醛的氢氟化反应条件优化。
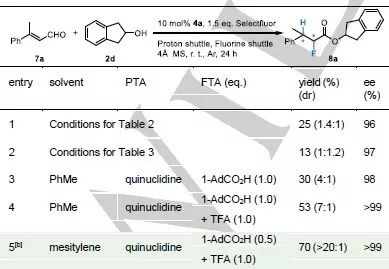
[b] 反应先在0 °C下进行12 h 后于室温反应24 h。
上述催化体系有利于β取代的烯醛化合物转化为含一个手性中心的α-氟取代羧酸衍生物。而当烯醛化合物中有两个β取代基时,β-质子化反应的速率将会受到影响,使酯化副反应提前发生,因此需选用空间位阻更大的2d(表4)作为NHC转化的牺牲剂。
接着该工作致力于解决β,β-双取代烯醛化合物的氢氟化反应的立体选择性问题。由表4可以看出前述的两种反应条件不适用于该反应(表4,第1-2行)。因此引入了质子化转移试剂奎宁与氟化试剂1-金刚烷甲酸(表4,第3行)使目标产物的产率与dr值得到提高。但由于1-金刚烷甲酸的酸性较弱无法使质子完全转移至奎宁环上,因此又加入了三氟乙酸(表4,第4行)。此外还采用了梯度温度反应的策略来进一步提高目标产物的产率与dr值(表4,第5行)。
表4 β-烃基β-芳基取代烯醛化合物非对映与对映选择性的氢氟化反应底物拓展。
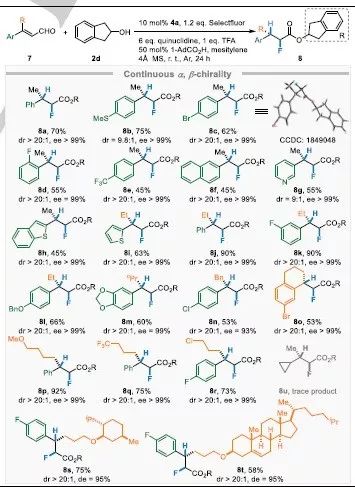
接着研究了上述反应条件下β,β-双取代的烯醛化合物的氢氟化反应的底物普适性(表5)。β-芳基取代的烯醛化合物均可以被转化为目标产物(8b-8e);该催化体系对于含有β-杂环取代的底物(8g-8i)也同样适用。底物中的β-甲基也可以替换为其他的烷烃取代基(8j-8r)。含有环外双键的烯醛化合物也可以被高选择性地转化为目标产物(8o)。但该催化体系对于β-双烃基取代的烯醛化合物是不适用的(8u)。当β-烃基为结构复杂的左旋薄荷醇或胆固醇取代基时,这两种底物也可以被转化为相应的目标产物(8s-t)。
 总结与展望
总结与展望 该工作通过氮杂环卡宾催化烯醛化合物的连续不对称β-质子化-α-氟化反应,高选择性地一步合成了含有两个连续手性中心的含氟羧酸衍生物。研究表明选择合适的质子化与氟化试剂对于抑制副反应的发生尤为重要。在β-芳基取代的烯醛化合物与β-烷基取代的烯醛化合物的不对称氢氟化反应中羧酸盐同时作为质子化与氟化试剂;而对于更具挑战性的β,β-双取代的烯醛化合物来说,则需要奎宁、三氟乙酸和1-金刚烷甲酸作为质子化与氟化试剂。这一合成策略对于有机催化及不对称合成在医药分子的合成中的应用具有指导作用。
文献链接
Enantio- and diastereoselective hydrofluorination of enals via N-heterocyclic carbene catalysis. (Angew. Chem. Int. Ed. 10.1002/anie.201902989)
原文链接:
http://dx.doi.org/10.1002/anie.201902989
以上工作由黄湧教授、陈杰安副研究员共同指导,由博士后王乐明、博士研究生江新航共同完成。
供稿丨深圳市清新电源研究院
部门丨媒体信息中心科技情报部
撰稿人丨Star sheep
主编丨张哲旭

清新电源投稿通道(Scan)

这篇关于用access将两个表合成一个表_北大深研院黄湧课题组Angew:卡宾催化连续手性中心的一步构筑及含氟羧酸衍生物的合成...的文章就介绍到这儿,希望我们推荐的文章对编程师们有所帮助!







