本文主要是介绍药物设计中的人工智能(Artificial Intelligence in Drug Design,2022),希望对大家解决编程问题提供一定的参考价值,需要的开发者们随着小编来一起学习吧!
药物设计中的人工智能
Artificial Intelligence in Drug Design
编者:亚历山大·海菲兹
出版商:美国胡马纳出版社
2022年
前言
创新疗法的设计是一个创造性的过程,涉及结合传统和新的分子建模技术同化和分析可用的实验数据。这可能是一个极其复杂、漫长和昂贵的过程。人工智能(AI)和机器学习(ML)方法的应用有望彻底改变设计-制造-测试-分析(DMTA)周期,加快药物设计过程,从而降低成本。在过去的几年里,人工智能/机器学习领域已经从主要的理论研究转向了现实世界的应用。图形处理单元(GPU)的可用性和深度学习(DL)等AI/ML算法的进步在很大程度上促成了这种爆炸性增长。神经网络在深度学习算法中的使用使计算机能够通过从数据中学习来模仿人类的智能。这些方法的应用可以在药物设计的多个方面得到利用。
本书概述了AI/ML/DL方法在药物设计中的开发和应用现状。涵盖的主题包括:如何应用这些方法来加速和彻底改变传统的药物设计方法,如基于结构和配体的、增强的和多目标的从头药物设计、SAR和大数据分析、结合/活性预测、ADMET、药物动力学和药物靶点停留时间,精准用药和有利的化学合成路线预测。还讨论了这些方法的应用范围,以及它们在当今和不久的将来对生产力的最大影响。对这些主题的审查将使包括计算机和药物化学家、药理学家和药物设计师在内的不同受众能够了解现有技术和挑战,并更好地了解正在开发的新方向。
亚历山大·海菲兹
英国牛津郡
目录
第1章 人工智能在药物设计中的应用:机遇与挑战
1. 简介:药物设计面临哪些挑战?
2. 人工智能在药物设计中的应用
2.1. 虚拟筛选
2.2. 计算机辅助合成规划
2.3. 从头分子生成
3. 药物设计中人工智能决策面临的挑战
3.1. 预测置信度
3.2. 可解释性
3.3. 适当的验证
4. 结论
参考文献
第2章 机器学习应用于药理学和ADMET终点的建模
1. 简介
2. 机器学习应用于ADMET问题
2.1. 有利的ADMET分布的重要性
2.2. 数据、描述符、算法、指标
2.3. 数据是关键
2.4. 机器学习算法
2.5. 描述符
2.6. 性能指标
2.7. 稳定且高性能模型的识别
2.8. 适用领域
2.9. 化合物和多个终点的模型
2.10. 应用实例
3. 总结与展望
参考文献
第3章 用人工智能对抗COVID-19
1. 简介
2. 基于结构的药物再利用
3. 人工智能在药物再利用中的应用
3.1. 深度学习
3.2. 图表示学习或网络邻近分析
4. 正在研究的再利用药物
5. 挑战与未来展望
参考文献
第4章 人工智能和机器学习在药物发现中的应用
1. 简介
2. 生成化学
3. 靶点分析
4. ADMET预测和评分
5. 合成规划
6. 结论
参考文献
第5章 深度学习和计算化学
1. 简介
1.1. 人工智能简史
2. 深度学习在计算化学中的应用
2.1. QSAR
2.2. 生成建模
2.3. 大规模虚拟筛选的主动学习
2.4. 深度学习和插补
3. 深度学习的影响
4. 深度学习的未决问题
4.1. 可解释性
4.2. 成本和复杂性
5 . 深度学习的未来
参考文献
第6章 人工智能影响了药物发现吗?
1. 简介
2. 从头设计工具
3. 在药物发现中采用人工智能和生成模型
4. 从早期到现在
5. 生成模型的使用:分布式学习与集中学习
6. 在药物发现中的应用
7. REINVENT:使用生成模型
8. 库的从头设计
9. 人工智能应用面临的挑战及未来发展
参考文献
第7章 网络驱动的药物发现
1. 动机
2. 网络生物学和药理学
3. 对药物发现的影响
3.1. 网络识别
3.2. 功能冗余
3.3. 网络扰动
3.4. 远距离作用
4. 网络驱动的药物发现
5. 验证
5.1. COVID-19
6. 总结
参考文献
第8章 利用机器学习预测GPCR配体的停留时间
1. 简介
1.1. 赋予药物靶点较长停留时间的特性
1.2. 以前使用过的ML方法预测RT
2. 材料
3. 方法
3.1. 动力学结合数据
3.2. 针对单个靶点的仅配体特征的QSKR
3.3. 根据分子动力学模拟获得的特征训练多目标QSKR模型
4. 注意事项
参考文献
第9章 使用化学语言模型进行从头分子设计
1. 简介
2. 材料
2.1. 计算方法
2.2. 数据
3. 方法
3.1. SMILES符号
3.2. 循环神经网络
3.3. 训练和采样设置
3.4. 生成聚焦分子库
3.5. 结果分析
3.6. 最后的考虑因素
4. 注意事项
参考文献
第10章 QSAR深度神经网络
1. 简介
2. 分子特征化
2.1. 特征向量
2.2. 分子图像
2.3. 分子图
2.4. SMILES字符串
2.5. 无监督嵌入
3. 深度神经网络架构
3.1. 多层感知器
3.2. 卷积神经网络
3.3. 图卷积神经网络
3.4. 长短期记忆
4. 提高模型性能
4.1. 超参数优化
4.2. 多任务学习
4.3. 迁移学习
5. 模型解读
5.1. 不确定性估计
5.2. 特征重要性
6. 总结
参考文献
第11章 基于结构的药物设计中的深度学习
1. 简介
2. 评分函数
2.1. 卷积神经网络
2.2. 其他架构
3. 基于结构的虚拟筛选
3.1. 评分预测
3.2. 结合模式预测
4. 展望
参考文献
第12章 深度学习应用于基于配体的从头药物设计
1. 简介
2. 从头设计:历史和背景
3. 用于从头设计的神经网络架构
4. 基于配体的深度生成模型在药物从头设计中的应用
5. 突破基于配体的深度生成方法的界限
6. 结论
参考文献
第13章 通过深度学习进行超高通量蛋白质-配体对接
1. 简介
2. 材料
2.1. 化学库
2.2. 蛋白质准备
2.3. 对接方案
3. 方法
3.1. 蛋白质-配体对接的深度学习
3.2. 模型类型和特征化
3.3. 分析
4. 注意事项
参考文献
第14章 人工智能和量子计算成为下一个制药颠覆者
1. 简介
2. 方法
2.1. 人工智能基础知识
2.2. 人工智能在药物发现中的应用与发展
2.3. 量子计算如何加速药物发现?
3. 结论
参考文献
第15章 化合物设计中的人工智能
1. 简介
2. 材料
3. 方法
3.1. 生成化学结构
3.2. 训练生成网络
3.3. 基于人工智能的从头设计的奖励函数
3.4. 化学可行性
3.5. 内部工作流程中评分功能的集成
3.6. 化合物选择和过滤
3.7. 实际例子:工作中的人工智能设计
4. 总结
5. 注释
参考文献
第16章 现实药物设计案例中的人工智能、机器学习和深度学习
1. 简介
2. 应用领域
2.1. 基于结构的虚拟筛选(SBVS)
2.2. 基于配体的虚拟筛选(LBVS)
2.3. 药物再利用
2.4. 药物敏感性
2.5. 从头设计
2.6. 反应和合成可及性
2.7. ADME[T]预测
2.8. 量子力学(QM)
3. 结论与展望
参考文献
第17章 人工智能支持的可合成新型化合物的从头设计
1. 简介
2. 计算分子生成
3. 逆合成规划和合成可行性评估
4. 合成可行性与深度生成算法的结合
5. 结论
参考文献
第18章 从组学数据进行机器学习
1. 简介
2. 数据探索
3. 模型定义
4. 超参数搜索
5. 模型验证
6. 最终模型的训练和解释
参考文献
第19章 治疗性抗体开发中的深度学习
1. 简介
2. 抗体开发中的监督学习
2.1. 生物物理特性
2.2. 产品质量属性
2.3. 过程行为
3. 抗体开发中的无监督学习
3.1. 迁移学习无监督和自监督模型
4. 结论
参考文献
第20章 用于计算机ADMET预测的机器学习
1. 简介
2. 材料
2.1. 数据集概述
2.2. 描述符集概述
2.3. 机器学习算法
2.4. 软件
2.5. 计算机硬件
3. 方法
3.1. 训练和测试集准备
3.2. 机器学习模型训练和性能评估
3.3. 模型部署和自动化
3.4. 性能监控
3.5. 训练ADMET模型时的其他提示
4. 注意事项
5. 总结
参考文献
第21章 人工智能应用于药代动力学预测的机遇与思考
1. 简介
2. DMPK的演变
3. 人工智能在PK预测中的机会
3.1. 个别参数
3.2. 总体概况
3.3. 定量预测与分类
3.4. 数据可视化
3.5. 生命周期考虑因素
4. 数据质量
4.1. 体外数据
5. 体内数据
5.1. 观测数据作为“黄金标准”
6. 机遇与未来挑战
6.1. 机制与经验主义
6.2. 新模式
7. 前瞻性视角
参考文献
第22章 药物安全和代谢中的人工智能
1. 简介
1.1. 定量SAR的历史
1.2. 毒理学史
1.3. 计算毒理学史
2. 方法
2.1. 模型及其用途
2.2. 模型精度
2.3. 适用范围
2.4. 相似性的重要性
2.5. 预测药代动力学
3. 计算毒理学模型的应用
3.1. 心脏毒理学
3.2. 肝毒理学
3.3. 遗传毒理学
3.4. 体内药代动力学
3.5. 数字病理学
4. 未来展望
参考文献
第23章 使用匹配的分子对进行分子构思
1. 简介
2. MMP算法
3. BioDig:GSK转换数据库
4. 使用MMP进行大规模分子构思
5. 量化基于MMP的知识库的价值
6. 新转换不断增长的尾巴
7. 有用的MedChem转换子集
8. 评估MMP作为分子生成工具
9. 第一次测试——包含人类
10. 第二次测试——模拟人类
11. 第三次测试——遗留项目
12. 结论
参考文献
摘要
第1章 人工智能在药物设计中的应用:机遇与挑战
人工智能(Artificial intelligence,AI)近年来发展迅速,并已成功应用于药物设计等现实问题。在本章中,我们回顾了人工智能在药物设计问题上的最新应用,包括虚拟筛选、计算机辅助合成规划和从头分子生成,重点关注人工智能在其中应用的局限性和改进机会。此外,我们还讨论了人工智能在将理论实践转化为现实世界药物设计方面所带来的更广泛的挑战;包括量化预测不确定性和解释模型行为。
第2章 机器学习应用于药理学和ADMET终点的建模
近年来,众所周知的定量构效关系(QSAR)概念引起了人们的极大兴趣。数据、描述符和算法是构建有用模型的主要支柱,这些模型支持使用计算机方法进行更高效的药物发现过程。所有三个领域的重大进步是人们重新对这些模型产生兴趣的原因。在本书章节中,我们回顾了利用许多化合物的体外/体内测量数据的各种机器学习(ML)方法。我们将这些与其他数字药物发现方法结合起来,并提供一些应用示例。
第3章 用人工智能对抗COVID-19
用于治疗COVID-19的疫苗的开发正在为新的希望铺平道路。尽管如此,病毒突变为疫苗抗性变种的风险仍然存在。因此,对治疗COVID-19的有效药物的需求仍然是现实的。为此,科学家们继续寻找并重新利用已上市药物来治疗这种新疾病。其中许多药物目前正在进行临床试验,到目前为止,只有一种药物已获得 FDA 正式批准。与新分子的标准药物开发相比,药物再利用是一条更快进入临床的途径,但在大流行中,这一过程仍然不足以阻止病毒的传播。人工智能已经在加速药物发现过程中发挥了重要作用,不仅有助于选择潜在的候选药物,而且还有助于监测大流行并更快地诊断患者。在本章中,我们重点关注人工智能迄今为止在治疗2019冠状病毒病(COVID-19)的药物再利用方面所表现出的影响和挑战。
第4章 人工智能和机器学习在药物发现中的应用
机器学习(ML)和深度学习(DL)是人工智能(AI)的两个子类,在当今大数据时代,通过将数据转化为信息并最终转化为知识,为药物发现研究和开发提供了重要机会。机器学习或人工智能并不是什么新鲜事物,但在过去几年中,更好的方法的应用已经出现,并且它们已成功应用于药物发现和开发。本章将概述这些方法以及它们如何在药物发现过程中的各种工作流程中应用,例如生成化学、ADMET预测、逆合成分析等。本章还将尝试提供盲目使用这些方法的警告和陷阱,同时总结挑战和局限性。
第5章 深度学习和计算化学
在人工智能方法应用最新复苏的背景下,深度学习近年来经历了复兴。这些方法已应用于计算化学中的许多问题。与其他机器学习方法相比,深度神经网络的实际性能优势通常不清楚。然而,深度学习似乎确实提供了许多其他优势,例如多任务学习的轻松结合和生成建模的增强。由于训练此类模型的成本以及解释其预测的挑战,当代网络架构的高度复杂性对其未来的采用构成了潜在的重大障碍。当与非常大的数据集相对缺乏相结合时,思考深度学习是否可能对计算化学产生通常认为在图像识别等其他领域所产生的那种变革性影响是很有意义的。
第6章 人工智能影响了药物发现吗?
人工智能(AI)工具在药物发现中的应用越来越广泛,支持设计-制造-测试-分析(DMTA)周期的每个阶段。本章的主要重点是借助深度神经网络(DNN)在分子生成中的应用。我们对该领域的主要进展进行了历史概述。我们分析了分布和目标导向学习的概念,然后重点介绍了生成模型在药物设计中的一些最新应用,重点关注生物制药行业的研究工作。我们更详细地介绍了REINVENT,这是我们阿斯利康团队开发的开源软件,也是公司许多药物化学项目的AI分子设计支持的主要平台,我们还展示了我们在库设计方面的一些工作。最后,我们提出了人工智能在药物发现中应用的一些主要挑战,以及应对这些挑战的不同方法,这些挑战定义了当前和未来的工作领域。
第7章 网络驱动的药物发现
我们描述了一种明确涉及人类生物学复杂性的早期药物发现方法。组合的计算和实验方法是在一个概念框架上制定的,其中网络生物学用于在单个分子实体和这些实体在网络中相互作用时出现的细胞表型之间建立桥梁。解决了早期发现的多个方面,包括数据驱动的疾病相关生物过程的阐明、靶点识别和验证、活性分子的表型发现及其作用机制,以及从人类群体遗传学数据中提取遗传靶点支持。通过对一些发现项目的总结和针对COVID-19疾病的项目的详细信息来描述验证。
第8章 利用机器学习预测GPCR配体的停留时间
在一些蛋白质家族中,药物靶点停留时间(即与给定蛋白质靶点结合的持续时间)已被证明比结合亲和力对于赋予功效更重要。为了对药物发现中的停留时间进行有效优化,需要开发可以预测该值的机器学习模型。预测停留时间的主要挑战之一是数据缺乏。本章概述了所有当前可用的配体动力学数据,提供了一个包含迄今为止最大的公开可用的GPCR配体动力学数据源的存储库。为了帮助解读可能有益于包含在预测停留时间的计算模型中的动力学数据的特征,总结了影响停留时间的特性的实验证据。最后,概述了通过机器学习预测停留时间的两种不同的工作流程。第一个是基于配体特征训练的单靶点模型;第二个是根据分子动力学模拟生成的特征进行训练的多靶点模型。
第9章 使用化学语言模型进行从头分子设计
人工智能(AI)为药物化学中的苗头和先导化合物发现提供了新的可能性。人工智能的多个实例已被用于前瞻性药物设计。其中,化学语言模型已被证明在各种实验场景中表现良好。在这项研究中,我们提供了化学语言建模的实践介绍。详细讨论了一种基于循环神经网络的技术,并提供了将该人工智能方法应用于重点化合物库设计的分步指南。程序代码可在以下网址免费获取:github.com/ETHmodlab/de_novo_design_RNN。
第10章 QSAR深度神经网络
定量构效关系(QSAR)模型是药物发现过程中常规应用的计算工具。QSAR模型是回归或分类模型,根据分子结构的特征来预测分子的生物活性。这些模型通常用于对未来实验室实验的候选分子列表进行优先排序,并帮助化学家更好地了解结构变化如何影响分子的生物活性。因此,开发准确且可解释的QSAR模型在药物发现过程中至关重要。深度神经网络是一种强大的监督学习算法,在解决包括制药行业在内的各个研究领域的回归和分类问题方面显示出了巨大的前景。在本章中,我们简要回顾了深度神经网络在QSAR建模中的应用,并描述了提高模型性能的常用技术。
第11章 基于结构的药物设计中的深度学习
计算方法在药物发现中发挥着越来越重要的作用。基于结构的药物设计(SBDD)尤其包括考虑大分子靶点结构的技术,以预测可能与结合位点建立最佳相互作用的化合物。当前对基于深度神经网络的机器学习算法的兴趣鼓励了深度学习在SBDD相关问题中的应用。本章涵盖了这一活跃研究领域的精选著作。
第12章 深度学习应用于基于配体的从头药物设计
近年来,应用深度生成模型来建议虚拟化合物正在成为药物发现项目中的一种新的强大工具。本次综述背后的想法是提供基于人工智能(AI)算法的从头设计方法的最新观点,特别关注基于配体的方法。我们首先简要概述了在使用人工智能技术之前开发的最相关的从头设计方法。然后,我们描述了当今基于配体的从头设计中最常见的神经网络架构,以及文献(2017-2020)中发现的100多个深度生成模型的最新列表。为了展示生成方法如何深入应用于药物发现背景,我们报告了所有现有的研究,其中合成了生成的化合物并测试了它们的生物活性。最后,我们讨论了我们设想的深度生成模型在从头药物设计中进一步应用的有益未来方向。
第13章 通过深度学习进行超高通量蛋白质-配体对接
超高通量虚拟筛选(uHTVS)是一个将经典对接技术与高通量人工智能方法结合在一起的新兴领域。我们概述了机械对接模型的目标和成功。我们主要通过代理对接模型为uHTVS提供不同的人工智能加速工作流程。我们展示了一种新颖的特征表示技术,即分子描述(图像),作为对接的替代模型。除了讨论使用数百亿规模的回归富集表面分析筛选之外,我们还概述了具有深度学习的uHTVS筛选流程的未来。

图1 典型的对接概述分为理论组成部分。(a)化合物库通常使用2D标识符(例如SMILES或Inchi Keys)来准备,尽管它们可以以3D格式(例如SDF或MOL2)找到。(b)构象异构体生成创建从库中的2/3D化合物采样的低能3D构象集合。此外,在此步骤中,如果需要,可以通过枚举立体异构体来增加整体大小。(c)对接:在蛋白质口袋内优化姿势以及整体中每个构象异构体的最终分数。(d、e)分析首先检索得分最高的整体构象异构体(有时是前n个)以进行下游分析。典型的最后一步是采取最佳得分姿势和分数,并仅使用相关分数和姿势(而不是整个分数集合)来注释原始起始结构
第14章 人工智能和量子计算成为下一个制药颠覆者
人工智能(AI)由增强的优化策略的协同组合组成,广泛应用于药物发现和开发,为提高整个药物生命周期的成本效益提供了先进的工具。具体来说,人工智能具有提高药物批准率、降低开发成本、更快地为患者提供药物以及帮助患者遵守治疗的潜力。加速药物开发和药品批准率可以进一步受益于量子计算(QC)技术,这最终将从受专利保护的市场独占权中获得更大的利润。
主要制药利益相关者正在认可基于人工智能和质量控制的尖端技术,涵盖药物发现、临床前和临床开发以及批准后活动。事实上,AI-QC应用预计将在未来5-10年内成为制药运营模式的标准。将可扩展性推广到更大的制药问题,而不是专业化,现在是在多个方面转变制药任务的主要原则,为此,系统且成本效益高的解决方案已在分子筛选、合成途径设计以及药物发现和开发等领域受益。
通过数据驱动分析、神经网络预测和化学系统监控将药物生命周期与人工智能和/或质量控制相结合而生成的信息将能够(1)更好地理解过程数据的复杂性,(2)简化设计实验,(3)发现新的分子靶点和材料,以及(4)规划或重新思考即将到来的制药挑战。AI-QC的力量使人们能够了解一系列不同的药物问题及其合理化,这些问题以前由于缺乏适当的分析工具而没有得到解决,这表明了这些新兴的多层面方法的潜在应用范围。在这种背景下,制定正确的人工智能-质量控制策略通常需要一个陡峭的学习路径,特别是考虑到行业发展的萌芽阶段以及相对缺乏记录成功的案例研究。因此,对潜在支柱的全面了解对于扩展整个药物生命周期的应用前景至关重要。
本章所包含的主题将重点关注应用于药物发现和开发的AI-QC方法,重点关注该领域的最新进展。
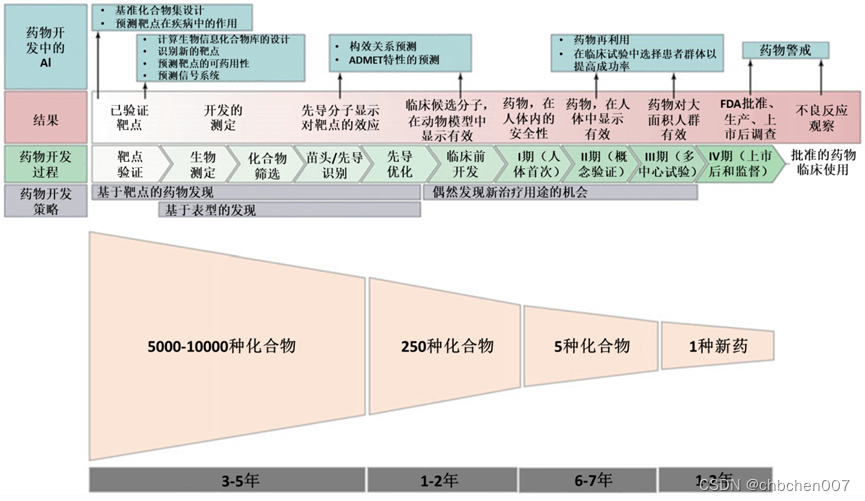
图1 典型的药物发现和开发时间表。药物开发要求每种批准用于人体的新药通常需要经过5000-10000种化合物的实验室筛选。在筛选的化合物中,大约250种将进入临床前测试,平均而言,在进入临床测试的5种化合物中,只有一种获得治疗用途批准。药物批准的整个过程可能需要10至15年
第15章 化合物设计中的人工智能
近年来,人工智能取得了令人难以置信的快速发展。不同的研究小组推出了许多用于药物分子性质预测以及新型分子设计的新技术。这些基于人工智能的设计方法可用于在先导化合物生成或骨架迁越中建议新颖的化学基序,以及在先导化合物优化期间优化所需的特性曲线。在先导化合物生成中,需要对化学空间进行广泛采样以识别新的基序,而在先导化合物优化阶段,对当前先导化合物系列的化学邻域进行详细探索是有利的。这些对成功设计结果的不同要求使得人工智能技术的不同组合变得有用。总体而言,我们观察到,将不同方法与定制的评分和评估方案相结合似乎有利于高效的基于人工智能的化合物设计。
第16章 现实药物设计案例中的人工智能、机器学习和深度学习
药物的发现和开发是一个漫长而昂贵的过程,而且损耗率很高。计算药物发现通过使用描述配体特性及其与生物靶标相互作用的模型,有助于配体发现和优化。近年来,在新算法以及计算能力和存储容量增加的推动下,人工智能(AI)在建模方面取得了显着进展,可以在短时间内处理大量数据。这篇综述提供了应用于药物发现的人工智能方法的最新技术,重点是基于结构和配体的虚拟筛选、库设计和高通量分析、药物再利用和药物敏感性、从头设计、化学反应以及合成可及性、ADMET和量子力学。
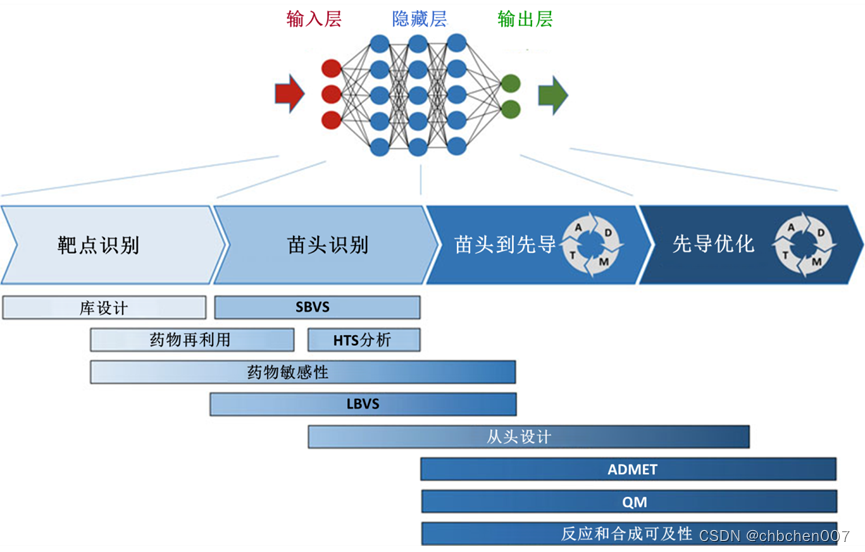
图1 早期药物发现流程的流程图,显示了四个主要阶段:靶标识别、命中识别、命中先导和先导优化。流程图下方,根据使用人工智能方法的阶段来放置使用人工智能方法的活动域
第17章 人工智能支持的可合成新型化合物的从头设计
过去三十年来,药物发现科学家一直对开发计算机辅助从头设计方法以快速发现治疗人类疾病的新化合物感兴趣。一开始,主要致力于通过逐个原子和/或逐个组的顺序构建分子来产生适合靶蛋白活性位点的分子,同时探索所有可能的构象,以优化与靶蛋白的结合相互作用。近年来,深度学习方法被应用于生成针对结合假设(以优化效力)和药物相似性预测模型(以优化特性)迭代优化的分子。通过这些从头方法产生的分子的可合成性仍然是一个挑战。本综述将重点关注合成规划方法的最新发展,这些方法适用于增强从头方法设计的分子的可合成性。
第18章 从组学数据进行机器学习
机器学习(ML)已经加速了许多科学领域的发现,并且是多种新产品背后的驱动力。最近,不断增长的样本量使得机器学习方法能够在更大规模的组学研究中使用。这项工作提供了使用机器学习对组学数据集进行典型分析的指南。作为示例,本章演示了如何基于LINCSL1000数据集中包含的转录组学数据构建预测药物性肝损伤的模型。每个部分都涵盖了从数据探索和模型训练(包括超参数搜索)到最终模型的验证和分析的最佳实践和陷阱。重现结果的代码可在https://github.com/Evotec-Bioinformatics/ml-from-omics上找到。
第19章 治疗性抗体开发中的深度学习
应用于抗体开发的深度学习正处于青春期。数据量低和生物平台差异使得开发可以预测实际商业开发步骤中抗体行为的监督模型具有挑战性。但是,模拟一般蛋白质行为和早期抗体模型的成功表明了抗体的普遍可能性,特别是因为抗体具有共同的折叠。与此同时,新的数据收集方法以及无监督和自监督深度学习方法的发展,如生成模型和掩蔽语言模型,为更好地开发有监督的模型提供了丰富而深入的数据集和深度学习架构。这些共同推动了该行业朝着提高可开发性、降低成本和更广泛的生物治疗途径发展。
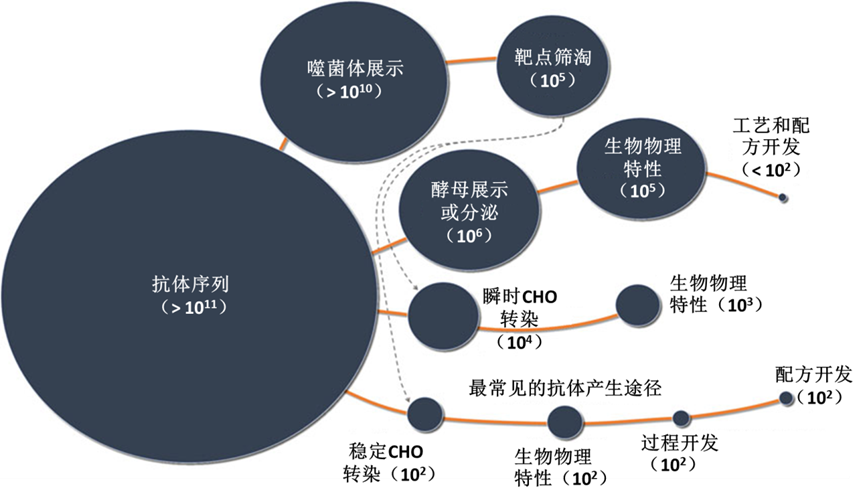
图1 最常见的抗体发现和开发活动以及预计在执行这些活动的商业组织中可用的序列的大致大小。发现和初步表征方面的数据非常丰富。随着工作转向以生产为导向的细胞系,数据量急剧减少,增加了使用深度学习的挑战
第20章 用于计算机ADMET预测的机器学习
ADMET(吸收、分布、代谢、排泄和毒性)描述药物分子的药代动力学和药效学特性。生物活性化合物的ADMET特性会影响其功效和安全性。此外,功效和安全性被认为是新化学实体开发中临床消耗的一些主要原因。在过去的几十年中,各种机器学习或定量构效关系(QSAR)方法已成功集成到ADMET建模中。最近在药物发现和开发过程的早期阶段,在数据收集和各种计算机方法的开发方面取得了进展,以评估和预测生物活性化合物的ADMET。
第21章 人工智能应用于药代动力学预测的机遇与思考
制药行业预测人类药代动力学行为能力的提高归功于1990年至今的重大技术变革。基于人工智能/机器学习的方法在制药行业的应用机会是由各个制药和生物技术公司内存在的丰富数据集以及这些环境中丰富的计算能力的可用性推动的。本章旨在描述人工智能在整个药物发现和开发过程中有助于评估和评价新化合物的代谢和药代动力学(DMPK)特性的机会。关于人工智能/机器学习在预测药代动力学曲线方面的应用,许多举措已经在进行中,因此问题不在于人工智能是否会影响药代动力学预测,而在于如何最好地利用和整合它,以及如何评估这些应用的附加值。由于我们了解ADME的体外和体内系统的基本生物学,基于人工智能的方法的关键挑战之一将是适应质量随时间变化的数据集的能力。
第22章 药物安全和代谢中的人工智能
人工智能方法在药物安全领域的应用始于2000年代初期,其应用包括预测细菌致突变性和hERG抑制等。此后,该领域不断扩大,模型也变得更加复杂。这些方法现已与体外和体内方法一起整合到分子风险评估过程中。如今,人工智能可用于药物发现和开发的各个阶段,从早期发现中的化学库分析,到发现中期阶段的脱靶效应预测,再到评估开发中潜在的诱变杂质和作为生命一部分的降解物周期管理。本章概述了人工智能在药物安全中的应用,并描述了其在整个发现和开发过程中的应用。
第23章 使用匹配的分子对进行分子构思
匹配分子对分析(Matched Molecular Pair Analysis,MMP)是药物发现先导化合物优化阶段非常重要的工具。该工具在先导化合物优化阶段的有用性已在多篇同行评审的文章中讨论过。MMP在分子生成中的应用相对较新。这带来了几个挑战,其中之一就是需要将上下文信息编码到转换中(to encode contextual information into the transforms)。在本章中,我们将讨论如何使用MMP作为分子生成方法,以及它与其他分子生成器的比较。
这篇关于药物设计中的人工智能(Artificial Intelligence in Drug Design,2022)的文章就介绍到这儿,希望我们推荐的文章对编程师们有所帮助!