本文主要是介绍iMeta | 江南大学陈卫院士团队探究清酒乳杆菌对炎症性肠病的种间差异机制,希望对大家解决编程问题提供一定的参考价值,需要的开发者们随着小编来一起学习吧!
点击蓝字 关注我们
清酒乳杆菌对炎症性肠病的种间差异:通过比较基因组学和代谢组学分析潜在机制

iMeta主页:http://www.imeta.science
研究论文
● 原文链接DOI: https://doi.org/10.1002/imt2.136
● 2023年9月25日,江南大学陈卫团队在 iMeta 在线发表了题为 “Intra-specific difference of Latilactobacillus sakei on inflammatory bowel diseases: insights into potential mechanisms through comparative genomics and metabolomics analyses” 的文章。
● 本研究从中国各地120份发酵和粪便样本中获得了72株清酒乳杆菌。结果表明,有2株在缓解炎症性肠病(IBD)相关症状方面表现出不同程度的有效性,造成这些差异的可能原因是菌株之间碳水化合物活性酶和代谢物的差异。
● 第一作者:柳雅茹
● 通讯作者:于雷雷(edyulei@126.com)
● 合作作者:段慧、陈颖、张程程、赵建新、Arjan Narbad、田丰伟、翟齐啸、陈卫
● 主要单位:食品科学与资源挖掘全国重点实验室、江南大学功能食品国家工程技术研究中心、江南大学益生菌国际联合研究实验室
亮 点
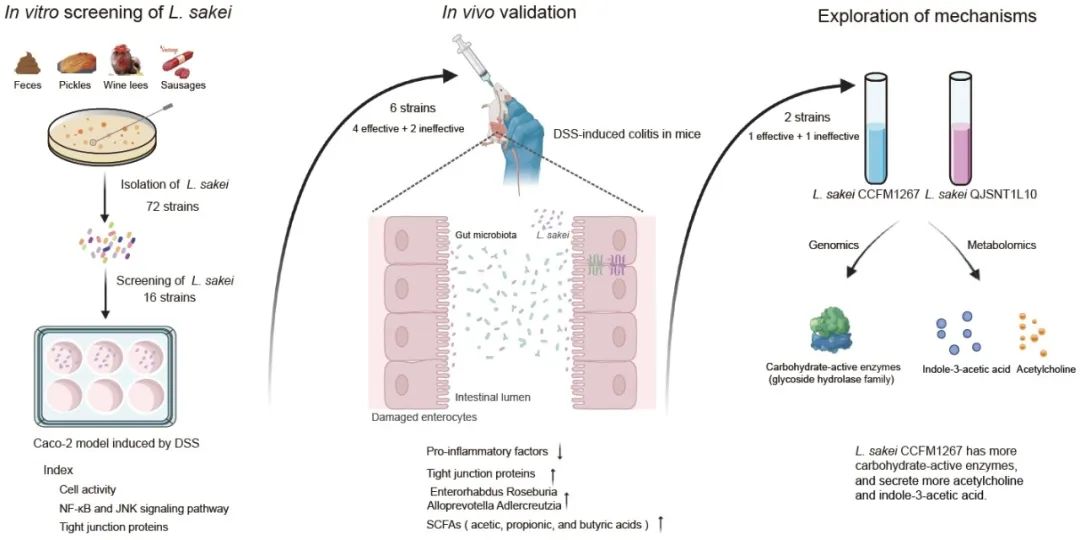
● 清酒乳杆菌在体外和体内模型中对炎症性肠病的影响存在特异性差异;
● 清酒乳杆菌碳水化合物活性酶的差异可能会对肠道微生物群产生影响,从而影响短链脂肪酸的产生,导致对炎症性肠病的缓解程度存在差异;
● 清酒乳杆菌的体外代谢组发现,乙酰胆碱和吲哚-3-乙酸被初步确定为可能导致其疗效差异的关键物质。
摘 要
炎症性肠病(IBD)是胃肠道慢性炎症性疾病,已成为全球健康负担。研究表明,清酒乳杆菌可以有效缓解各种免疫疾病,包括结肠炎、风湿性关节炎和代谢紊乱。在这里,我们从中国各地的120份发酵和粪便样本中获得了72株清酒乳杆菌。采用葡聚糖硫酸钠(Dextran Sulfate Sodium,DSS)诱导Caco-2体外模型,初步筛选了16株不同来源的清酒乳杆菌菌株。随后,选择6株菌株(4株有效,2株无效)在结肠炎小鼠中进行进一步验证。结果表明,清酒乳杆菌对结肠炎的发病过程有不同程度的改善作用。值得注意的是,最有效的菌株清酒乳杆菌CCFM1267显著恢复了结肠长度和紧密连接蛋白的表达,并降低了细胞因子和相关炎症酶的水平。此外,清酒乳杆菌CCFM1267上调了Enterorhamdus、Alloprevotella和Roseburia的丰度,导致乙酸和丙酸水平升高。相反,其他4个菌株(清酒乳杆菌QJSSZ1L4、QJSSZ4L10、QGZZYRHMT1L6和QGZZYRHMT2L6)仅表现出部分缓解作用,而QJSNT1L10表现出最小的影响。因此,我们选择CCFM1267和QJSNT1L10作为研究对象,进一步探讨其不同缓解效应的机制。比较基因组学分析揭示了两种菌株在碳水化合物利用相关基因如糖苷水解酶家族上存在显著差异。此外,代谢组学分析表明,乙酰胆碱和吲哚-3-乙酸是两种菌株的主要鉴别代谢物。因此,各菌株在缓解IBD相关症状方面表现出不同程度的有效性,造成这些差异的可能原因是菌株之间碳水化合物活性酶和代谢物的差异。
视频解读
Bilibili:https://www.bilibili.com/video/BV1j34y137mx/
Youtube:https://youtu.be/IAF_qVh_kJs
中文翻译、PPT、中/英文视频解读等扩展资料下载
请访问期刊官网:http://www.imeta.science/
全文解读
引 言
炎症性肠病(IBD)是一种肠道慢性炎症性疾病,表现为便血、腹痛、腹泻或消化不良等症状。根据临床特征主要分为克罗恩病(Crohn's disease, CD)和溃疡性结肠炎(Ulative colitis, UC)。CD主要是引发肠道的跨壁炎症,并发症包括肠肉芽肿、狭窄和瘘管,并可影响肠的任何部位(最常见的是回肠末端和结肠),通常是间断的。相反,UC引发的炎症局限于直肠和结肠区域的粘膜层,可能全部或部分影响结肠。流行病学研究表明,IBD影响350多万人。自1990年以来,由于工业化和城市化、生活方式的改变和饮食偏好,IBD的发病率在过去几十年中不断上升。如果IBD患病率保持在0.1%不变,到2025年,中国等人口密度高的国家估计将有超过150万IBD病例。IBD的病因和病理生理尚不清楚,然而,人们普遍认为,宿主基因组、环境因素、肠道微生物群、肠道屏障和免疫反应等复杂的相互作用导致了IBD的发生。因此,肠道菌群失调是IBD的关键致病因素。虽然在治疗IBD方面已经取得了一些成功,但是传统药物并不能减少IBD的总体病程。尽管这些治疗药物被广泛使用,但仍有相当一部分患者表现出耐药性,或在持续使用这些药物治疗时遇到挑战,此外,这些药物还伴有包括感染和恶性肿瘤风险在内的副作用。因此,利用益生菌来缓解或治疗IBD已成为一个突出的研究热点。
一些益生菌,包括长双歧杆菌、干酪乳杆菌、格氏乳杆菌、乳酸双歧杆菌及植物乳杆菌已被证明能够有效缓解IBD小鼠的肠道炎症,这表明研究特定肠道微生物群对IBD进展的贡献可以发现有效的治疗方案。在总结益生菌治疗IBD的机制时,研究已经确定了三个关键因素:(1)抑制肠道中病原微生物生长。研究表明,益生菌产生的抗菌肽或其他代谢物能够抑制肠道中其他微生物的生长活性。益生菌能够在肠道中代谢产生短链脂肪酸,这些酸类代谢物能够引起肠道特定pH值的变化,这些作用可能直接抑制病原菌的生长。另一方面,益生菌能与肠道病原微生物竞争肠道粘膜表面的受体或结合位点,并抑制上皮附着的肠毒素和肠致病细菌的入侵。(2)调节肠道免疫。IBD患者的肠道慢性炎症是由于免疫系统的异常激活引起的。肠道粘膜树突状细胞参与免疫系统的调控,影响Treg和Th17的分化以及粘膜特异性免疫球蛋白A(IgA)的产生和转换,它们的激活可能导致促炎细胞因子(IL-17,IL-23)的产生。益生菌会影响粘膜层的免疫系统,通过激活Toll样受体和辅助性T细胞1(Th1)分化来刺激抗体的分泌。益生菌还能够促进吞噬作用和NK细胞活性,诱导T细胞凋亡,刺激抗炎细胞因子如TGF-β的分泌。而一些促炎细胞因子(TGF-α,IF-γ)的分泌水平因受到抑制而降低。(3)改善肠道屏障。益生菌能够通过抑制肠上皮细胞凋亡和促进紧密连接蛋白的合成降低肠屏障通透性从而改善/恢复肠屏障功能。例如,罗伊氏乳杆菌R2LC增加了紧密连接蛋白Occludin和ZO-1的表达,保护小鼠免受结肠炎损伤。
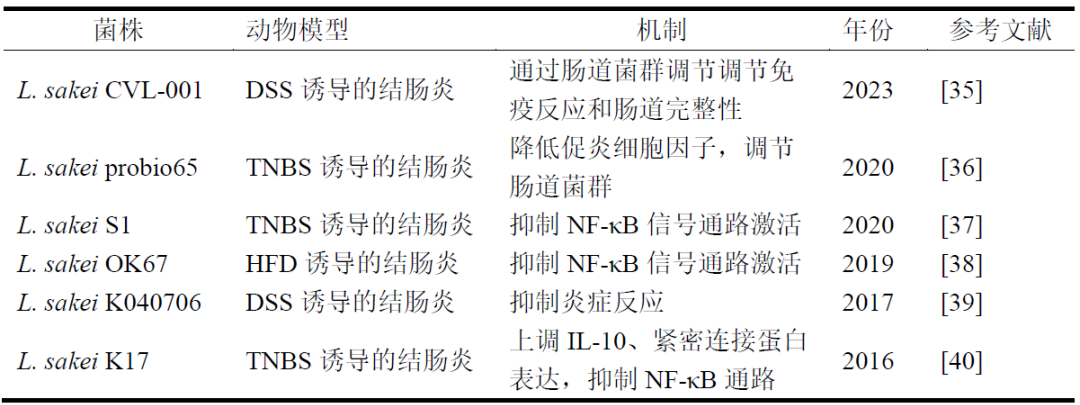
清酒乳杆菌是一种广泛存在于酵母、发酵泡菜、发酵肉制品等日常食品中的益生菌,由于其代谢产生细菌素和风味化合物,在食品工业中常被用作生物引发剂和保护剂。比较基因组学揭示了清酒乳杆菌的特定基因组特征,这些特征存在于包含一半泛基因集的广泛的基因组中,表明这些群体具有不同的环境偏好。菌株间的特异性差异主要表现在胍丁胺和柠檬酸盐代谢方面。所有菌株都存在编码果糖、蔗糖、海藻糖和葡萄糖酸盐代谢途径的基因,这意味着它们广泛适应富含植物性或含糖成分的环境。此外,蛋白质组学和转录组学研究已被用于阐明清酒乳杆菌在不同生态位中的代谢谱。益生菌的功能似乎也与其代谢产物密切相关。目前,被广泛研究的益生菌活性代谢物主要有胞外多糖、细菌素、有机酸、短链脂肪酸、维生素等。这些活性代谢物已被证明具有抗炎症、抗肿瘤、抗氧化、免疫调节和预防或治疗各种代谢性疾病等特性。Kim等和Tsuji等人对清酒乳杆菌的发酵过程进行了代谢组学分析,阐明了该物种在不同环境下的适应特性。值得注意的是,清酒乳杆菌显示出丰富的代谢物生产谱,包括胞外多糖和γ-氨基丁酸(GABA),这两种物质对人类的健康都有显著的好处。Bajpai等人观察到清酒乳杆菌产生的胞外多糖具有类似超氧化物歧化酶(SOD)的活性,并能有效抑制α-葡萄糖苷酶,显示出浓度依赖性的酪氨酸酶活性和丰富的多酚含量,表明清酒乳杆菌具有强大的抗氧化特性。在小鼠模型中,清酒乳杆菌产生的GABA与增强长期记忆恢复有关。此外,当与运动相结合时,GABA也能显著减少体重增加,从而起到抗肥胖的作用。宿主对肠道菌群信号处理的改变,以及肠道菌群组成和功能的改变,与IBD有很强的关联。因此,人们一直在探索清酒乳杆菌缓解结肠炎的潜在能力(表1)。然而,该菌株不同分离来源的免疫调节功能和机制尚未阐明。本研究旨在筛选不同来源的清酒乳杆菌,探讨清酒乳杆菌对IBD的种内差异,为进一步研究具有益生菌功能的清酒乳杆菌奠定理论基础。
表 1-1 具有结肠炎缓解功效的清酒乳杆菌
结 果
清酒乳杆菌的分离和筛选
通过普通MRS培养基,对收集到的来自全国不同地区的120份发酵样品及粪便样品进行分离筛选,共分离得到658株菌株,其中清酒乳杆菌72株,分别来自9个省,包括江苏省、安徽省、广东省、吉林省、浙江省、四川省、云南省、新疆省、贵州省,其中粪便源筛选得到12株,发酵肉制品筛选得到27株,发酵蔬菜筛选得到26株,发酵酒糟筛选得到7株,从不同样品中挑选16株不同分离源的清酒乳杆菌进行后续实验研究(图1A)。
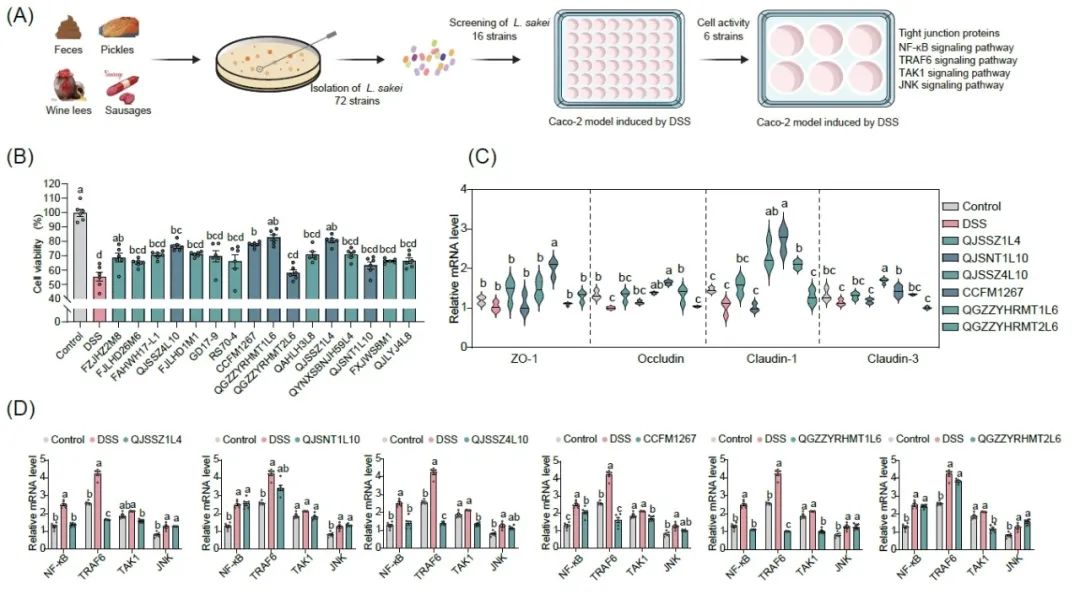
图 1. 清酒乳杆菌的体外筛选
(A)清酒乳杆菌体外筛选流程图。(B)清酒乳杆菌对DSS刺激后Caco-2细胞活性的影响。(C)清酒乳杆菌对DSS刺激后Caco-2细胞紧密连接蛋白表达水平的影响。(D清酒乳杆菌对DSS刺激后Caco-2细胞相关免疫通路表达水平的影响。图中不同小写字母(a-c)表示各组之间的显著性差异(P < 0.05),采用Tukey多重比较检验(n = 6)。
清酒乳杆菌的体外免疫调节能力探索
从不同样本中筛选出16株不同来源的清酒乳杆菌,并通过DSS诱导的Caco-2细胞模型初步研究了清酒酵母菌的体外免疫调节活性。首先,选择合适的DSS(图S1)和细菌浓度(图S2)。随后的实验使用了接近细胞半致死量的3% DSS和107 CFU/mL的细菌浓度。我们测定了清酒乳杆菌对受DSS刺激的Caco-2细胞活性的影响(图1B)。清酒乳杆菌CCFM1267、QGZZYRHMT1L6、QJSSZ1L4和QJSSZ4L10显著缓解了DSS对Caco-2细胞活性的抑制作用,能使Caco-2细胞的存活率提高至74%以上。而清酒乳杆菌QJSNT1L10和QGZZYRHMT2L6并未对Caco-2细胞活性表现出显著的保护作用,细胞活性仅为63.23%和57.94%。基于以上结果,本研究挑选上述6株清酒乳杆菌进行后续实验。图1D表明,除清酒乳杆菌QJSNT1L10和清酒乳杆菌QGZZYRHMT2L6外,其余4株清酒乳杆菌均能显著下调Caco-2细胞中NF-κB基因的表达水平。图1C显示,DSS刺激后下调了Caco-2细胞中Claudin-1、Claudin-3、Occludin及ZO-1四类紧密连接蛋白相关基因的表达水平,这与Hwang等人报道的结果一致。而清酒乳杆菌不同程度的恢复了Caco-2细胞紧密连接蛋白相关基因的表达。
清酒乳杆菌对DSS诱导的结肠炎小鼠的缓解作用评价
在DSS诱导的结肠炎小鼠模型中进一步验证了该研究,以评估上述6株清酒乳杆菌的免疫调节活性(图2A)。DSS造模后,小鼠结肠长度从空白组的5.8 cm缩短至4.5 cm (图2B, S3)。对照组小鼠结肠泛红且粪便呈颗粒状,而造模组小鼠结肠肿胀出血且粪便稀松,这与Chen等人研究结果一致。灌胃清酒乳杆菌QJSSZ4L10和CCFM1267后,结肠长度分别恢复到5.2 cm和5.4 cm,显著改善了结肠异常。其余4株菌对结肠长度无保护作用。DSS造模后小鼠体重降低15%左右,清酒乳杆菌CCFM1267显著缓解了这一影响,而清酒乳杆菌 QJSNT1L10和QGZZYRHMT2L6则没有缓解作用(图2C)。图2D显示,小鼠的结肠组织结构清晰,粘膜层表面光滑,上皮细胞形态规则,固有层中肠腺丰富,排列紧密;无炎性细胞浸润。而DSS造模后引起小鼠结肠粘膜层大面积坏死,固有层中肠腺消失并伴有中等量的中性粒细胞浸润;黏膜下层小面积水肿,结缔组织疏松并伴有少量炎性细胞浸润。菌株干预后,清酒乳杆菌CCFM1267对结肠损伤的保护效果最好,其结肠组织状态与对照组相似。相反,清酒乳杆菌QJSNT1L10在一定程度上加重了小鼠结肠组织的损伤,小鼠结肠固有层中大量肠腺坏死消失并伴有中性粒细胞浸润,粘膜层小面积水中且结缔组织排列疏松。
本研究还测定了小鼠结肠组织中紧密连接蛋白的含量变化从而评估不同清酒乳杆菌对肠道屏障的保护作用。如图2E所示,清酒乳杆菌CCFM1267干预后显著上调了四类紧密连接蛋白(Claudin-1、Claudin-3、ZO-1和Occludin)的含量;与此相反,清酒乳杆菌QJXNT1L10和QGZZYRHMT2L6均未表现出明显恢复作用。清酒乳杆菌干预后都一定程度地影响了小鼠结肠细胞因子水平,特别是清酒乳杆菌QJSSZ4L10和CCFM1267,它们显著降低TNF-α、IL-6和IL-17水平(图2I-L),增加IL-10水平(图2M)。此外,清酒乳杆菌CCFM1267干预后,COX-2、iNOS和MPO水平降至对照组水平,有效缓解肠道炎症(图2F-H)。
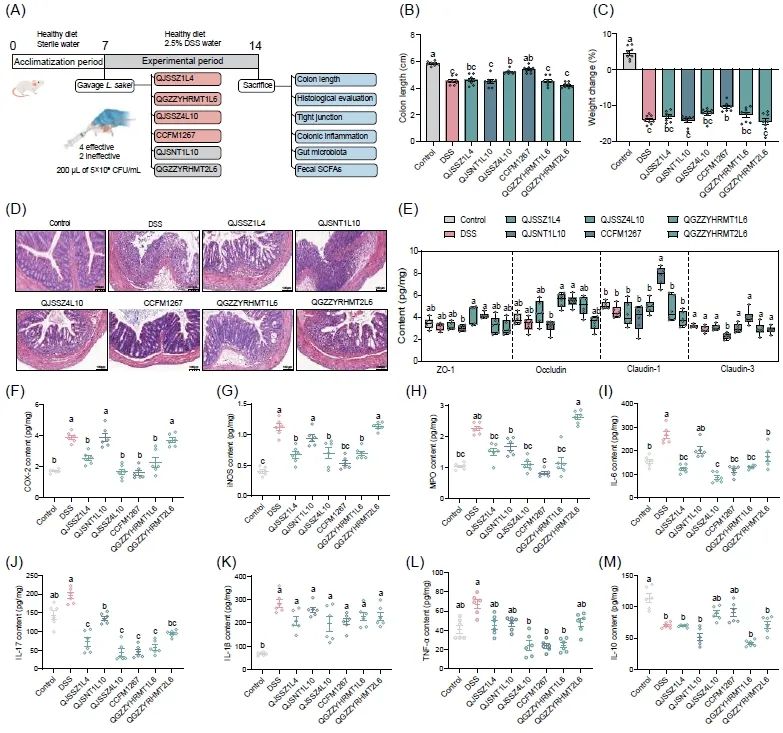
图2. 清酒乳杆菌改善DSS诱导的小鼠结肠炎
(A)动物实验流程图。(B,C)清酒乳杆菌对结肠炎小鼠生理指标的影响。(D)清酒乳杆菌对结肠炎小鼠结肠组织学形态影响。(E)清酒乳杆菌对结肠炎小鼠结肠紧密连接蛋白含量的影响。(F-H)清酒乳杆菌对结肠炎小鼠炎症酶含量的影响。(I-M)清酒乳杆菌对结肠炎小鼠细胞因子含量的影响。图中不同小写字母(a-c)表示各组之间的显著性差异(P < 0.05),采用Tukey多重比较检验(n = 8)。
清酒乳杆菌对小鼠肠道菌群和短链脂肪酸的影响
肠道微生物在人类生理活动中发挥重要的功能,它能够参与病原体防御、营养、代谢和调节免疫系统等多种活动。然而,肠道菌群也可能导致溃疡性结肠炎和结直肠癌等疾病的发生。本研究选取清酒乳杆菌CCFM1267和QJSNT1L10分别作为缓解结肠炎效果最好和最无效的菌株,分析了清酒乳杆菌菌株对结肠炎小鼠菌群的调节作用。如图3A所示,清酒乳杆菌并没有显著调节肠道微生物群的α-多样性。清酒乳杆菌CCFM1267组Shannon指数最高,表现出了较高的物种丰富度。关于β-多样性(图3B),PCA图显示对照组、DSS组和清酒乳杆菌干预组之间存在一定的分散,表明肠道微生物群结构发生了改变。门水平分析(图3D, 3F)显示,清酒乳杆菌上调了DSS诱导的厚壁菌门的下降,同时下调了拟杆菌门的丰度。LEfSe分析显示,结果表明不同实验组间共存在乳杆菌属(Lactobacillus)、Romboutsia属、肠杆菌属(Enterorhabdus)、罗氏菌属(Roseburia)、颤杆菌克属(Oscillibacter)等24个差异菌属(图3E)。与DSS组相比,清酒乳杆菌干预后肠道中的乳杆菌属的相对丰度明显上调(图3G),这可能与清酒乳杆菌的摄入有关。与清酒乳杆菌QJSNT1L10相比,清酒乳杆菌CCFM1267能够提高肠杆菌属(Enterorhabdus)、罗氏菌属(Roseburia)及拟普雷沃氏菌属(Alloprevotella)的相对丰度(图3G)。与DSS组相比,清酒乳杆菌CCFM1267干预后安德克氏菌属(Adlercreutzia)丰度显著上调(图3G),该菌属已被证明能够通过代谢异黄酮发挥抗炎作用。Oscillibacter属与结肠炎疾病严重程度呈正相关,然而,清酒乳杆菌CCFM1267显著下调了该属的相对丰度(图3G)。
小鼠粪便中也检测到大量的短链脂肪酸。如图3C所示,DSS造模后降低了粪便内总短链脂肪酸的水平,乙酸、丙酸、丁酸等的水平也较对照组小鼠有所降低。当给予结肠炎小鼠清酒乳杆菌后,粪便内各短链脂肪酸水平呈现上调趋势。相较于清酒乳杆菌QJSNT1L10,清酒乳杆菌CCFM1267对短链脂肪酸的上调趋势更为明显。其中,清酒乳杆菌CCFM1267对丙酸的上调最为显著。
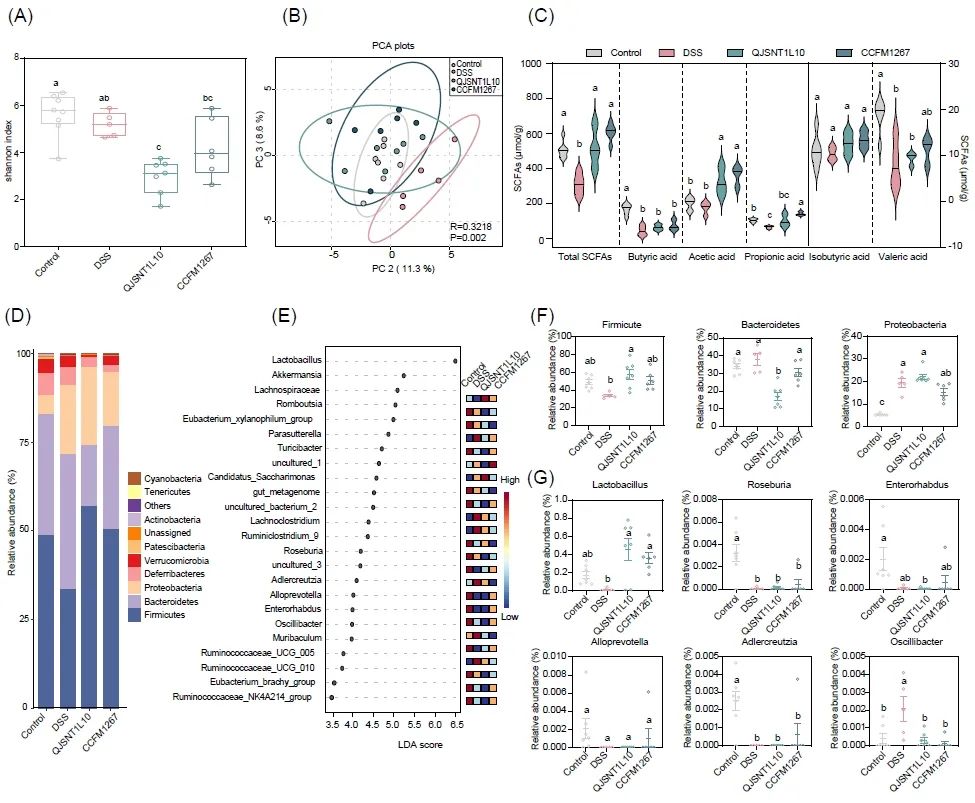
图3. 清酒乳杆菌对结肠炎小鼠肠道菌群的影响
(A)小鼠肠道菌α多样性。(B)小鼠肠道菌群β多样性。(C)清酒乳杆菌对结肠炎小鼠短链脂肪酸含量的影响。(D,F)清酒乳杆菌对结肠炎小鼠肠道菌群门水平的影响。(E)清酒乳杆菌干预后结肠炎小鼠肠道菌群属水平LEfSe差异分析。(G)清酒乳杆菌干预后差异菌属相对丰度。图中不同小写字母(a-c)表示各组之间的显著性差异(P < 0.05),采用Kruskal-Wallis检验组间差异。(对照组:n = 7;DSS: n = 5;CCFM1267: n = 6;QJSNT1L10: n = 7)。
不同菌种缓解结肠炎作用差异的机制
差异菌株的比较基因组分析
为了进一步探究不同清酒乳杆菌缓解结肠炎的机制差异,对2株差异菌从基因层面和代谢层面进行分析。首先基于比较基因组学,从基因层面上对2株清酒乳杆菌的核心基因和功能基因进行分析。直系同源基因分析结果表明(图4B),2株清酒乳杆菌共享1670个同源基因。在特有基因数量上,2株菌存在显著差异。清酒乳杆菌QJSNT1L10拥有135个特有基因而清酒乳杆菌CCFM1267拥有299个特有基因。平均核苷酸一致性(ANI)(图4C)和系统发育(图4D)显示,清酒乳杆菌CCFM1267与Latilactobacillus sakei subsp. sakei DSM 20017聚为一支,而清酒乳杆菌QJSNT1L10与Latilactobacillus sakei subsp. carnosus DSM 15831聚为一支,说明两株菌可能分属于清酒乳杆菌的两个亚种,它们遗传进化上的差异可能导致了其功能上的差异。
为了深入了解2株清酒乳杆菌基因组功能基因分布,利用COGs和KEGG数据库对两个菌株的基因组进行比较。各菌株的基因组中,与碳水化合物利用相关的功能基因占据了较大比例且存在一定差异 (图S4, S5;表S2,表S3)。因此,将2株清酒乳杆菌的基因组与CAZy数据库比对。如图4E可知,2株清酒乳杆菌均含有碳水化合物活性酶的主要四大家族,包括碳水化合物酯酶(Carbohydrate esterases,CEs)、糖苷水解酶(Glycoside hydrolases,GHs)、糖基转移酶(Glycosyl transferases,GTs)及辅助活性酶(Auxiliary activities,AAs)。2株菌在AAs、CEs及GTs三类家族上的基因分布无明显差异,而对于GHs家族,清酒乳杆菌CCFM1267较清酒乳杆菌QJSNT1L10而言相关基因数目更多。
种内差异的代谢组分析
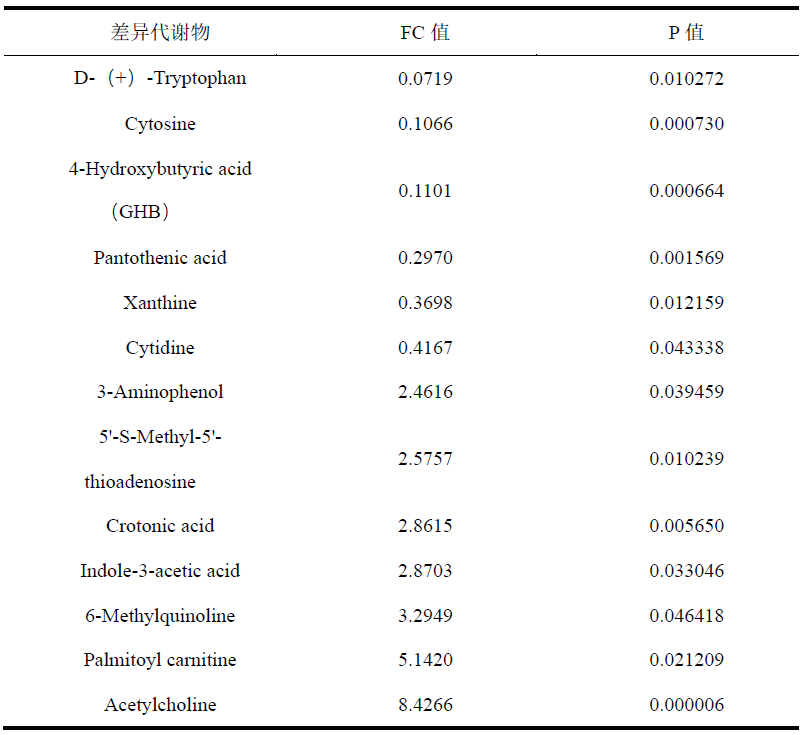
我们通过OPLS-DA观察到两菌株的代谢物存在显著差异(图4G)。以VIP > 1和p < 0.05为标准,筛选清酒乳杆菌CCFM1267与QJSNT1L10的差异代谢物,结果如图4H所示。总体而言,清酒乳杆菌CCFM1267和QJSNT1L10检测到的代谢物有193种(VIP > 1),无显著性差异代谢物165个。以FC > 2或FC < 0.5为标准进一步筛选差异显著的代谢物。2株清酒乳杆菌共存在13个显著差异代谢物(表2)。与清酒乳杆菌QJSNT1L0相比,清酒乳杆菌CCFM1267代谢更多的乙酰胆碱和吲哚-3-乙酸。
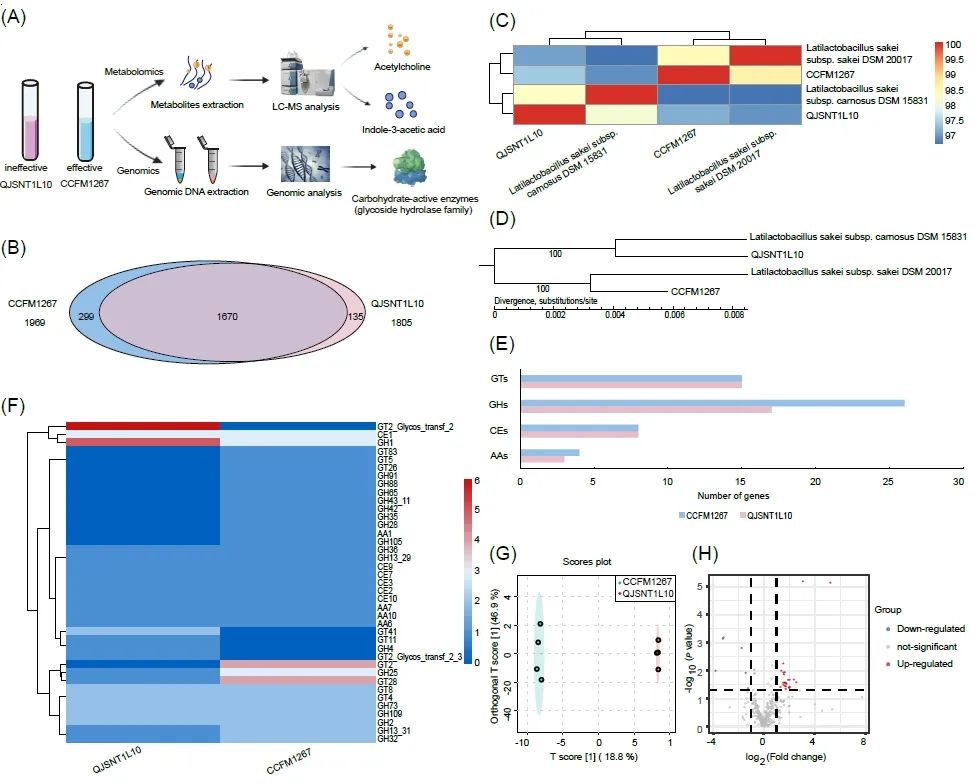
图4. 清酒乳杆菌对结肠炎小鼠肠道菌群的影响
(A)不同属比较基因组分析和代谢组学分析流程图。(B)清酒乳杆菌直系同源基因分析。(C)清酒乳杆菌平均核苷酸一致性分析。(D)清酒乳杆菌系统发育分析。(E,F)清酒乳杆菌的碳水化合物活性酶分析。(G)清酒乳杆菌全部代谢物特征的OPLS-DA得分图。(H)差异代谢物火山图。
表2. 清酒乳杆菌CCFM1267与清酒乳杆菌QJSNT1L10差异代谢物
方法
清酒乳杆菌的筛选
筛选自粪便样本(JNU20220901IRB01),发酵肉制品和发酵蔬菜产品的清酒乳杆菌培养在MRS培养基中,37°C,24h后,在6000 ×g,4℃的条件下离心5 min收集菌体。菌体使用0.9%的生理盐水洗涤并重悬,调整终浓度为5×109 CFU/mL,待后续实验使用。所有通过16S rRNA测序鉴定为清酒乳杆菌的菌株保存在30%甘油中,在-80°C冰箱中保存。
MTT试验
从美国ATCC生物标准资源中心获得的Caco-2细胞采用根据先前的培养方法。当Caco-2细胞铺板率达85%后,在37℃的条件下,用含有0.02%EDTA的胰酶消化液消化细胞并传代。将细胞以6000个/孔的浓度接种于96孔板中,孵育24 h, PBS洗涤2次,并加入1%、1.5%、2%、2.5%和3%五个浓度的DSS及103 CFU/mL-107 CFU/mL的清酒乳杆菌,分别与细胞共孵育24 h。孵育结束后用PBS洗涤细胞两次,使用MTT法测定细胞活性。选择合适的造模浓度后,按上述方法铺板。对照组加入空白培养基,其余各组加入含3% DSS的培养基,实验组中加入不同菌种的菌悬液,与细胞共孵育24 h,测定细胞活性。
RNA提取及实时定量PCR(RT-qPCR)
使用Total RNA Isolation Kit (RC101-01, 50 rxn)提取总RNA,随后使用HiScript III逆转录酶(R302-01, 1000 U)逆转录成cDNA。接下来的步骤是在BioRad-CFX384机器(Bio-Rad, California, USA)上使用SYBR Green Supermix进行。PCR反应的总体积为10 μl。热循环方案包括在95℃下初始变性30秒,然后在95℃下进行变性5秒,60℃下进行退火/延伸30秒,循环40次。PCR扩增后,进行熔化曲线分析(范围从65℃到95℃,增加0.5℃)以验证扩增片段的特异性。相关引物序列如表S1所示。通过2-ΔΔCT计算靶基因的相对变化水平。
动物实验设计
动物实验在SPF级屏障环境中进行。将72只雄性SPF C57BL/6N小鼠随机分为8组,每组9只,分别为对照组、DSS组、清酒乳杆菌QJSSZ1L4组、清酒乳杆菌QJSNT1L10组、清酒乳杆菌QJSSZ4L10组、清酒乳杆菌CCFM1267组、清酒乳杆菌QGZZYRHMT1L6组和清酒乳杆菌QGZZYRHMT2L6组。所有研究方案均经中国江南大学伦理委员会批准(伦理编号为:JN.No20210615c1040810[176])。实验第一周给予正常饮食和自由饮水,进行适应。实验开始后,使用0.9%的生理盐水溶液灌胃对照组小鼠和造模组小鼠,每只小鼠灌胃200 μL。而其余6组小鼠分别灌胃200 μL 109 CFU/mL不同清酒乳杆菌菌悬液。对照组小鼠饮用正常水,造模组小鼠和6组清酒乳杆菌干预组小鼠饮用2.5%的DSS饮水。最后用异氟醚处死小鼠,取肠内容物、肠、血清等样品。
组织学评价
在多聚甲醛固定液(4%)中对结肠组织(0.5 cm左右)进行固定。固定24 h后,采用Yang等的方法制备小鼠结肠切片并进行H&E染色。借助Pannoramic MI1I数字切片扫描仪扫描制作好的切片,观察结肠组织病理损伤情况。
小鼠结肠组织中紧密连接蛋白含量、细胞因子和炎性酶的测定
于450 μL的无菌生理盐水中放入0.5 cm的结肠组织进行组织研磨,离心10 min后收集组织匀浆上清液。参照森贝佳生物科技有限公司试剂盒的相关操作说明书,测定上清液中紧密连接蛋白及炎症酶炎症酶COX-2、iNOS、MPO的含量。使用酶联免疫分析试剂盒测定上清液中每种炎症细胞因子的水平。
小鼠肠道菌群组成的测定
使用Fast DNA Spin Kit for Feces试剂盒提取小鼠粪便中的总DNA,进行V3-V4区扩增。使用TIANgel Mini Purification Kit试剂盒对扩增后的DNA凝胶进行回收纯化。DNA的测序分析借助Illumina MiSeq PE300平台完成。
小鼠粪便中短链脂肪酸的测定
将小鼠粪便冻干并称重。随后,在样品中加入1ml饱和氯化钠溶液,组织匀浆机研磨后参照Tian等人的方法提取短链脂肪酸,采用气相色谱-质谱联用(GC-MS)进行分析。
清酒乳杆菌基因组测序、组装与注释
采用二代测序平台 Illumina Hiseq×10进行清酒乳杆菌的基因组测序,SOAPdenovo 2(http://soap.genomics.org.cn/)用于二代测序后序列的局部组装和优化。清酒乳杆菌基因组中的编码序列通过Glimmer(http://ccb.jhu.edu/software/glimmer/index.shtml)软件预测。
清酒乳杆菌基因组分析
源基因和系统进化树分析。清酒乳杆菌的直系同源基因及直系同源蛋白序列通过Orthomcl v2.0.9进行聚类分析获得。MAFFT-7.313用于构建系统发育树。
平均核苷酸一致性分析。使用JspeciesWS(http://jspecies.ribohost.com/jspeciesws/)计算任意2株清酒乳杆菌基因组之间的相似性,并利用R语言对分析结果进行热图绘制。
COG 功能基因注释分析。
利用蛋白质直系同源簇数据库(COGs)对清酒乳杆菌的基因组序列进行比对,获取相关功能基因分类结果。
KEGG功能基因注释
利用Diamond软件对京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes, KEGG)数据库中的菌株进行注释,该数据库提供KEGG的Orthology信息,并与KEGG数据库中的菌株进行比对,得到基因名称、所涉及的代谢途径等各种注释信息。
碳水化合物活性酶分析
利用CAZy(http://www.cazy.org/)网页对碳水化合物活性酶家族基因进行分类。
代谢组学分析
菌株活化两代培养到指数期后,在6000 ×g,4℃的条件下离心5 min收集上清。样品与甲醇按1:4的比例混合,超声处理5min,在-20℃下静置1h以去除蛋白质。在4°C,12,000 rpm离心15分钟后,蒸发上清液。然后用预冷甲醇-水(甲醇与超纯水体积比为4:1)进行溶解,相同条件下离心,获得足够体积的上清液用于LC-MS分析。使用 Compound Discoverer 初步筛选并导出样品代谢物结果。整合阳离子及阴离子模式下代谢物的峰面积,归一化后通过SIMCA 14.1计算代谢物的VIP值并绘制PLS-DA图,分析样品的聚类结果。
统计分析
本研究涉及的所有实验结果均为三次平行测定结果。采用Microsoft Excel、GraphPad 8、R语言进行实验数据的统计整理与作图。实验结果均以平均值 ± 标准误来表示。差异的显著性通过单因素方差分析(ANOVA)来检验评估。P值小于0.05被认为具有显著差异性。
讨 论
IBD是一种影响胃肠道的慢性炎症性疾病,主要流行于北美、西欧和北欧、澳大利亚和新西兰,近年来在亚洲和南美地区迅速增加。IBD通常会导致正常菌群对免疫系统的过度刺激,引发一系列炎症反应。此外,它经常复发,常规治疗不足以维持长期的疾病缓解。因此,发现有效和安全的替代治疗方案至关重要。研究表明,IBD病因与肠道菌群失调和免疫反应异常有关。益生菌已显示出改善肠道菌群和调节免疫反应的功效。它们副作用小,安全性高,可有效预防或辅助IBD治疗。越来越多的证据表明,乳酸菌具有多种益生菌功能。然而,该菌株不同分离源的免疫调节功能和机制尚未得到证实。本研究旨在筛选不同来源的清酒乳杆菌,探讨清酒乳杆菌对IBD的种内差异,为进一步研究具有益生菌功能的清酒乳杆菌奠定理论基础。体内和体外的研究结果表明,不同来源的清酒乳杆菌的缓解作用存在差异。值得注意的是,与缓解效果较差的清酒乳杆菌QJSNT1L10相比,清酒乳杆菌CCFM1267代谢产生的乙酰胆碱和吲哚-3-乙酸可能是其有效的原因。
从中国120份发酵样品和粪便样品中筛选出72株清酒乳杆菌,并选择16株清酒乳杆菌进行体外免疫调节活性研究。近年来有研究发现,DSS诱导的Caco-2细胞模型与结肠炎早期的炎症反应密切相关。当使用一定浓度的DSS刺激Caco-2细胞,会造成细胞损伤。主要表现为Caco-2细胞紧密连接损伤导致的肠屏障损伤和肠通透性增加,同时还会伴有其他炎症性损伤。故该模型常被用作结肠炎体外模型。因此,我们通过该模型发现,在16株不同来源的清酒乳杆菌菌株中,清酒乳杆菌QJSSZ1L4、QJSSZ4L10、CCFM1267和QGZZYRHMT1L6能有效保护Caco-2细胞的活性。NF-κB和JNK信号通路是IBD的关键通路,在IBD患者的巨噬细胞和肠上皮细胞中被观察到过表达,并引发炎症级联反应,促进IL-1β、TNF-α、IL-6等多种促炎细胞因子的分泌。因此,阻断NF-κB和JNK信号通路被认为是治疗IBD的一种方式。我们发现,清酒乳杆菌可能能够通过降低NF-κB的表达水平来缓解炎症。同时,清酒乳杆菌CCFM1267能够显著上调四类紧密连接蛋白相关基因的表达水平,保护肠道屏障功能。相比之下,清酒乳杆菌QJSNT1L10和QGZZYRHMT2L6缺乏上述调控作用。
动物模型的进一步验证表明,这6株清酒乳杆菌菌株对结肠炎小鼠的疾病过程有不同程度的缓解作用。其中清酒乳杆菌CCFM1267能有效恢复结肠炎小鼠结肠长度,减轻病理性损伤。此外,完整的肠道屏障对于机体的生理功能和疾病预防至关重要,上皮紧密连接是维持肠道屏障的重要介质。研究表明,当肠屏障受到破坏时,肠道腔内内容物、致病菌和共生菌群就会转移至肠道固有层,从而导致炎症。Li等人研究表明,树舌多糖能够上调小鼠结肠组织内ZO-1、Occludin和Claudin-3的含量,恢复肠屏障从而有效缓解DSS诱导的结肠炎。我们也观察到清酒乳杆菌CCFM1267通过上调紧密连接蛋白的表达和下调促炎细胞因子及相关炎症酶的水平来减轻结肠炎,而清酒乳杆菌QJSNT1L10的缓解作用最小。有研究认为,IBD的发生可能与短链脂肪酸代谢缺陷有关。结肠炎患者肠道内一些短链脂肪酸产生菌如柔嫩梭菌相对丰度降低,导致了肠道内短链脂肪酸含量的降低,进而限制了结肠上皮细胞的能量供应以及对粘膜炎症反应的局部控制。短链脂肪酸能够有效维持机体肠道和免疫稳态,这些酸主要通过抑制肠上皮促炎细胞因子活性并抑制巨噬细胞中NF-κB信号通路的激活来发挥抗炎功效。此外,短链脂肪酸能够抑制肠道内大肠杆菌、沙门氏菌等致病性微生物的生长,与其竞争定殖位点。Shan等人研究发现,短链脂肪酸还能够修复受损的肠粘膜,因为其具有刺激杯状细胞分泌粘液的能力。我们发现与清酒乳杆菌QJSNT1L10相比,清酒乳杆菌CCFM1267的短链脂肪酸上调更为明显,其中对丙酸上调最为显著。研究表明,乙酸和丙酸能够激活GRP43,进而有效抑制结肠炎小鼠体内一些促炎细胞因子的分泌水平,增加抗炎细胞因子IL-10的分泌,增强黏膜免疫反应。这进一步解释了为什么清酒乳杆菌CCFM1267缓解结肠炎的效果优于清酒乳杆菌QJSNT1L10。此外清酒乳杆菌CCFM1267可能更好地改善一些短链脂肪酸产生属,肠杆菌属(Enterorhabdus)、罗氏菌属(Roseburia)及拟普雷沃氏菌属(Alloprevotella)的相对丰度,它们能够产生乙酸、丁酸等具有抗炎功效的短链脂肪酸从而达到缓解炎症的目的。这可能也是清酒乳杆菌CCFM1267组相较于清酒乳杆菌QJSNT1L10组能产生更多短链脂肪酸的原因。此外,清酒乳杆菌CCFM1267显著上调安德克氏菌属(Adlercreutzia)丰度,该菌属已被证明能够通过代谢异黄酮发挥抗炎作用。
益生菌的功能与它们的基因组和代谢组有着复杂的联系。因此,我们的研究旨在通过菌株基因组学和代谢组的比较分析来阐明潜在的机制(图4A)。许多非靶向研究一致强调了IBD患者肠道代谢组的实质性扰动,证实了肠道微生物群落中存在公认的生态失调。特别是,肠道微生物群的特定代谢物,即短链脂肪酸胆汁酸和色氨酸分解代谢物,在IBD的进展过程中会受到相当大的干扰。其中,微生物色氨酸分解代谢物,包括吲哚、吲哚丙烯酸、吲哚乙酸和色胺,是治疗IBD的靶点潜力。这些分解代谢产物已被证明可以作为芳烃受体的配体,随后导致先天和适应性免疫反应的改变,并保持屏障功能。基于比较基因组学和代谢组学,研究了不同菌株缓解结肠炎效果差异的潜在机制。ANI和系统发育分析表明,清酒乳杆菌CCFM1267和清酒乳杆菌QJSNT1L10分属于清酒乳杆菌的两个亚种。Latilactobacillus sakei subsp. sakei DSM 20017和Latilactobacillus sakei subsp. carnosus DSM 15831。它们在遗传进化上的差异可能导致了其功能上的差异。COGs、KEGG和碳水化合物酶注释分析显示,不同菌株在碳水化合物利用相关基因(如糖苷水解酶家族)上存在显著差异,这可能是造成短链脂肪酸差异的原因,从而导致了不同的缓解效果。随后,我们利用代谢组学对这两种菌株的代谢物进行了进一步的分析,结果显示,两菌株的代谢物差异显著,其中乙酰胆碱和吲哚-3-乙酸是关键物质。乙酰胆碱已被证明能够触发α7-烟碱乙酰胆碱受体(α7nAChR)依赖的烟碱抗炎途径,促进抗炎细胞因子的产生,有效缓解结肠炎。吲哚-3-乙酸能被芳香烃受体(AHR)识别,从而增加IL-22的分泌,保护肠上皮屏障功能,有效缓解炎症。Shi等人研究发现,植物乳杆菌KLDS 1.0386衍生的色氨酸代谢物吲哚-3-乙酸能够通过刺激IL-22/STAT3信号通路,有效缓解小鼠的炎症性肠病。这也进一步证实了本研究结果,乙酰胆碱和吲哚-3-乙酸可能是造成差异菌株缓解结肠炎效果差异的关键代谢产物。本研究初步探讨了不同菌株的体外缓解作用机制,并分析了不同菌株体外代谢产物的差异。然而,需要进一步的研究来阐明差异代谢物在疾病中的缓解作用、潜在的机制以及差异菌株是否通过代谢该物质在体内起作用。
综上所述,IBD是一种非常复杂的疾病,其直接病因和病理机制尚不完全清楚,其发病率在亚洲呈上升趋势。传统的药物治疗可能有副作用,然而,使用益生菌似乎是一种很有前途的治疗策略,因为益生菌具有抗炎和调节肠道微生物群的作用。益生菌耐受性良好,几乎没有副作用,使其成为治疗IBD的更好选择。益生菌可以影响IBD病理病因的各个方面,对患者起到保护作用。有必要了解它们的作用机制和所有性质。我们发现,从不同样品分离的清酒乳杆菌可以影响免疫细胞因子的表达、微生物组和代谢功能。不同来源的清酒乳杆菌对缓解DSS诱导的结肠炎有不同的疗效。清酒乳杆菌CCFM1267是一种治疗IBD的有前景的新型益生菌候选物。然而,并不是所有的益生菌都能有效治疗IBD,益生菌的剂量、间隔时间和总体治疗时间等问题还有待解决,缺乏统一的共识。益生菌对IBD的治疗效果及其不良反应由于缺乏可用的数据,仍然存在争议。近年来,细菌成分和代谢物出现了明显的分化,最终引入了“后生元”一词。这一概念有望为患者提供更安全的消费选择。新出现的证据表明,后生元制剂对宿主健康的影响可能与益生菌相关的影响相当,这在处理胃肠道疾病时尤其明。在特定情况下,使用后生元制剂似乎更为合理。因此,益生菌缓解结肠炎的根本依据可在未来的研究中深入挖掘,并通过更严格的随机、双盲、安慰剂临床试验进行进一步研究。
代码和数据可用性
本文中产生的数据包含在补充文件中。补充材料(图表、表格、脚本、图形摘要、幻灯片、视频、中文翻译版本和更新材料)可在在线DOI或imata Science http://www.imeta.science/中找到。
引文格式:
Ya-Ru Liu, Hui Duan, Ying Chen, Cheng-Cheng Zhang, Jian-Xin Zhao, Arjan Narbad, Feng-Wei Tian, Qi-Xiao Zhai, Lei-Lei Yu, Wei Chen. 2023. Intra-specific difference of Latilactobacillus sakei on inflammatory bowel diseases: insights into potential mechanisms through comparative genomics and metabolomics analyses. iMeta 2: e3. https://doi.org/10.1002/imt2.136
作者简介
柳雅茹(第一作者)
● 江南大学食品科学与工程专业2021级硕士。
● 目前研究方向为功能菌株挖掘及其在肠道健康中的应用,相关学术成果已发表于Gut Microbes、iMeta、Nutrients等期刊。

于雷雷(通讯作者)
● 江南大学食品学院副研究员。
● 主要研究领域为食品微生物的基础生理代谢、功能菌株挖掘、膳食多糖与肠道菌群互作及其在肠道健康中的应用研究。已在Science Bulletin, Engineering, Microbiome, iMeta, Gut Microbes等期刊发表SCI论文120余篇,其中近五年以第一作者或通讯作者发表SCI论文近40篇,获国家授权发明专利30余件。先后主持国家重点研发计划子课题,国家自然科学基金面上项目、江苏省优秀青年基金项目等国家级/省部级纵向项目10余项,获得教育部高等学校科学技术进步奖、中国食品科学技术学会科技创新奖、中国商业联合会科技进步奖等省部级奖励4项。
更多推荐
(▼ 点击跳转)
高引文章 ▸▸▸▸
iMeta | 引用7000+,海普洛斯陈实富发布新版fastp,更快更好地处理FASTQ数据
▸▸▸▸
iMeta | 德国国家肿瘤中心顾祖光发表复杂热图(ComplexHeatmap)可视化方法
▸▸▸▸
iMeta | 高颜值绘图网站imageGP+视频教程合集

1卷1期

1卷2期

1卷3期

1卷4期

2卷1期

2卷2期

2卷3期

2卷4期
期刊简介
“iMeta” 是由威立、肠菌分会和本领域数百位华人科学家合作出版的开放获取期刊,主编由中科院微生物所刘双江研究员和荷兰格罗宁根大学傅静远教授担任。目的是发表原创研究、方法和综述以促进宏基因组学、微生物组和生物信息学发展。目标是发表前10%(IF > 15)的高影响力论文。期刊特色包括视频投稿、可重复分析、图片打磨、青年编委、前3年免出版费、50万用户的社交媒体宣传等。2022年2月正式创刊发行!
联系我们
iMeta主页:http://www.imeta.science
出版社:https://onlinelibrary.wiley.com/journal/2770596x
投稿:https://mc.manuscriptcentral.com/imeta
邮箱:office@imeta.science
这篇关于iMeta | 江南大学陈卫院士团队探究清酒乳杆菌对炎症性肠病的种间差异机制的文章就介绍到这儿,希望我们推荐的文章对编程师们有所帮助!





