本文主要是介绍顶刊速递·人工智能在食管癌领域最新进展|24-06-05,希望对大家解决编程问题提供一定的参考价值,需要的开发者们随着小编来一起学习吧!
小罗碎碎念
本期分享的文章,主题是——人工智能+食管癌,建议搭配下面这期推文一起使用,效果更佳呦。
人工智能在消化道肿瘤中的最新研究【24年五月|顶刊速递·05-31】

想搞产学研的,或者是偏成果转化的同学/老师,重点关注第一二篇文章,一个是前瞻性研究,一个是实时辅助内镜医师,都具有很高的参考价值。
偏向于学术研究的,我觉得第四篇和第五篇文章很有意思,提到了多组学以及代谢组学,尤其是代谢组学,我之前的推文中也有一片文献提到过,很有意思,建议大家关注一下!!
我是罗小罗同学,明天见!!
交流群
欢迎大家来到【医学AI】交流群,本群设立的初衷是提供交流平台,方便大家后续课题合作。
目前群内成员已达三位数,大部分来自全国百强医院/前50院校。此外,小罗也借助自媒体,与华盛顿大学、北大、北航、华科、北科、南方医等院校的课题组建立了联系,欢迎更多的人加入我们的队伍!!
由于近期入群推销人员较多,已开启入群验证,扫码添加我的联系方式,备注姓名-单位,即可邀您入群。

一、前瞻性研究|深度学习协助检测食管癌及其癌前病变

文献概述
这篇文章是关于一项前瞻性、随机对照研究,该研究探讨了深度学习如何协助检测食管癌及其癌前病变。研究由Shao-wei Li等人进行,发表在《Science Translational Medicine》期刊上,于2024年4月17日上线。
研究背景:
食管癌是全球第七大常见癌症,食管鳞状细胞癌(ESCC)约占食管癌病例的90%,尤其在亚洲部分地区的发病率更高。早期食管癌在内镜或手术治疗下有较好的5年生存率,但许多患者在症状出现后才发现病情已进展到晚期。因此,提高早期ESCC的检测率是一个挑战。
研究方法:
研究者开发了一个基于深度卷积神经网络(CNN)的系统,用于检测食管癌和癌前病变(高风险食管病变,HrELs)。研究在浙江台州医院进行,招募了3117名50岁及以上的患者,随机分配到实验组(使用CNN辅助的内镜检查)和对照组(无辅助的内镜检查)。
研究结果:
实验组的HrELs检测率(1.8%)显著高于对照组(0.9%),实验组的检测率是对照组的两倍。系统对于检测HrELs的敏感性、特异性和准确性分别为89.7%,98.5%和98.2%。研究中没有发生不良事件。
结论:
深度学习辅助系统提高了内镜检查中HrELs的检测率,并且是安全的。深度学习辅助增强食管癌的早期诊断和治疗,并成为食管癌筛查的有用工具。
研究细节:
- 研究使用了名为ENDOANGEL-食管病变检测系统(ENDOANGEL-ELD)的深度学习架构。
- 系统包括两个主要功能和
五个深度卷积神经网络(DCNN)模块。 - 系统通过多中心数据集构建,数据集包含
191,744张胃食管镜图像。 - 系统能够实时监测并辅助识别食管解剖部位,记录观察时间,并在NBI观察期间检测和分类食管病变。
- 实验组和对照组的食管段检查时间没有显著差异。
- 研究还进行了亚组分析,发现在不同年龄、性别、麻醉状态和内镜经验的亚组中,实验组的
HrELs检测率均优于对照组。
讨论:
研究指出,尽管食管癌的发病率和新病例率在中国较高,但通过使用ENDOANGEL-ELD系统,检测率有了显著提升。研究还提到,与日本相比,中国食管癌的早期检测率有待提高。研究结果表明,ENDOANGEL-ELD系统有助于检测和分类食管癌。
限制和未来方向:
- 研究指出了一些限制,包括样本分布的变异性、缺乏对结果有效性的金标准确定,以及对小于50岁人群的筛查性能尚未确认。
- 研究建议进行大规模的多中心试验以进一步验证系统的性能。
重点关注
Fig. 1 展示了在这项研究中使用的深度学习系统 ENDOANGEL-ELD 的框架和功能。该系统由五个深度卷积神经网络(DCNN)模块组成,每个模块负责不同的任务,以协助内镜医生在实时监测过程中检测食管病变。
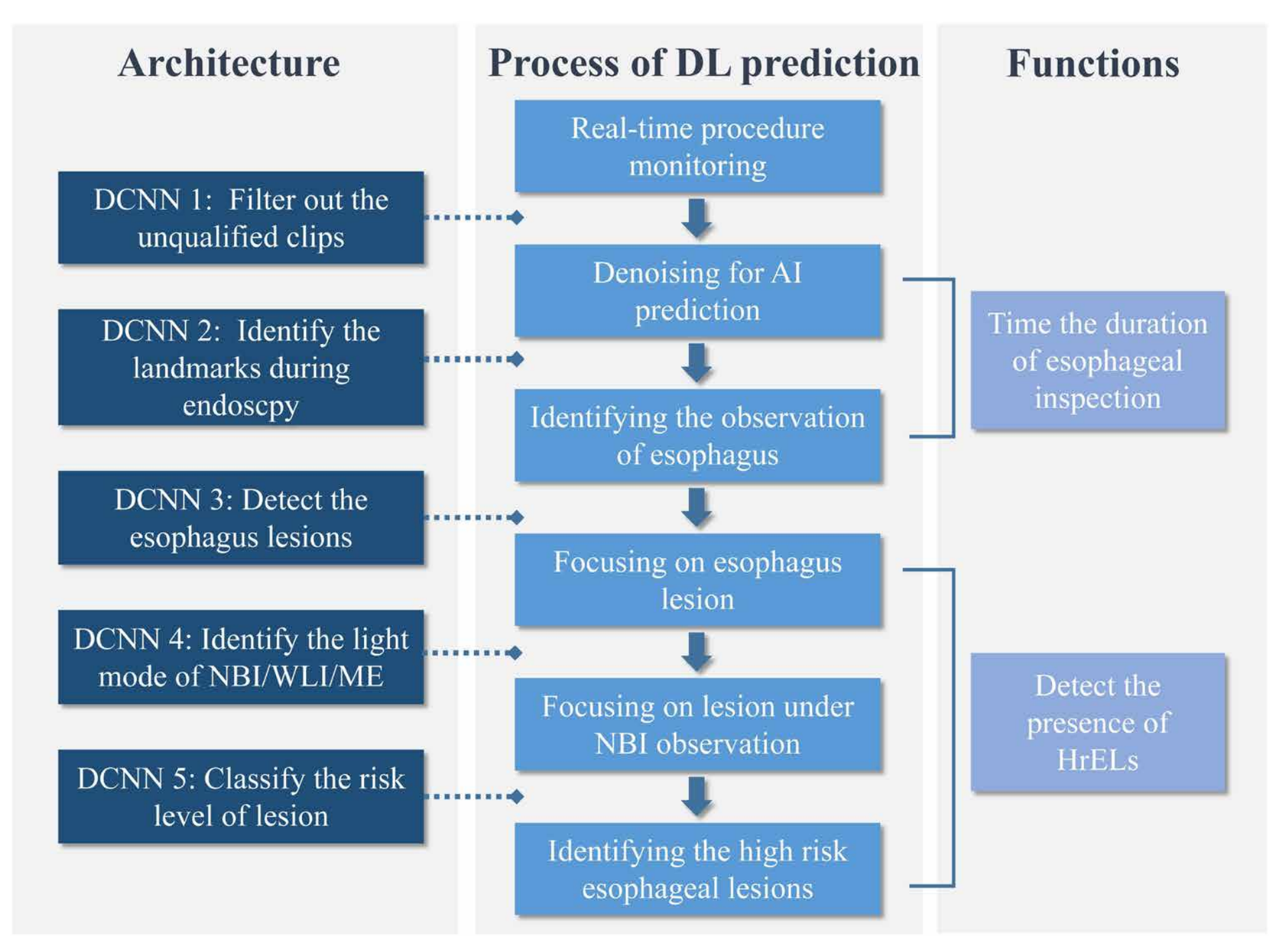
以下是对每个 DCNN 模块功能的分析:
-
DCNN 1 - 视频质量筛选:此模块的目的是过滤掉不合格的视频片段。在实时内镜检查过程中,并非所有捕获的视频片段都是有用的,DCNN 1 通过筛选出质量合格、可用于进一步分析的片段,以确保后续模块处理的图像数据是清晰且有用的。
-
DCNN 2 - 标志点识别:在获得清晰的图像后,DCNN 2 被激活用于识别图像中的标志点。这涉及识别食管的特定解剖特征,帮助系统确定内镜的位置,并为后续的病变检测提供准确的解剖背景。
-
DCNN 3 - 食管病变检测:此模块负责在食管观察过程中检测病变。DCNN 3 会分析图像以识别表明病变存在的任何异常,例如颜色变化、表面不规则性或其他可视特征。
-
DCNN 4 - 光源模式识别:检测到的食管病变随后被送入 DCNN 4,该模块用于识别不同的光源模式,包括白光成像(WLI)、窄带成像(NBI)和放大内镜(ME)。这有助于系统根据使用的光源技术来调整分析,因为不同的光源模式会影响病变的视觉表现。
-
DCNN 5 - 肿瘤风险分类:只有在 NBI 模式下检测到的病变才会被送入 DCNN 5 进行进一步分析。此模块的任务是评估病变的肿瘤风险,即判断病变是高风险(HrELs)还是低风险,并在监测屏幕上用红色或蓝色框标记出来,以警示内镜医生需要进一步关注或采取行动。
此外,系统还会记录和显示食管观察的持续时间,即对食管的观察时间。检测到的高风险病变(HrELs)会在监控屏幕上以可视化的方式表示出来,提醒内镜医生在操作过程中注意。
整体来看,这个系统通过自动化和智能化的方法提高了内镜检查的效率和准确性,有助于及早发现食管癌及其癌前病变,从而提高患者的生存率和治疗成功率。
二、人工智能辅助内镜诊断浅表性食管鳞状细胞癌及其癌前病变

文献概述
这篇文章是一项关于人工智能(AI)辅助系统在内镜诊断浅表性
食管鳞状细胞癌及其癌前病变中的应用的研究。
研究团队开发了一个AI系统,利用白光内镜(WLE)和非放大窄带成像(NBI)技术来检测这些病变,并在中国的12家医院进行了一项多中心、双盲、随机对照试验,以评估AI系统在实际临床环境中的辅助诊断性能。
研究包括了18岁及以上的患者,他们因筛查、调查胃肠道症状或监测而接受镇静上消化道内镜检查。患者被随机分配到AI优先组或常规优先组。在AI优先组中,内镜医师首先使用AI系统的辅助进行第一次检查,然后不使用AI系统进行第二次检查;常规优先组的检查顺序相反。主要结果是以每个病变和每个患者为基础计算的浅表性食管鳞状细胞癌及其癌前病变的遗漏率。
研究发现,在AI辅助组中,每病变遗漏率为1.7%,每患者遗漏率为1.9%,而在常规组中,这两个比率分别为6.7%和5.1%。两组中均观察到0.2%的患者出现食管病变活检后的出血,且没有报告严重不良事件。
研究的解释是,AI辅助内镜检查对减少浅表性食管鳞状细胞癌及其癌前病变的遗漏率具有一致的实质性益处,但效果大小不一,从显著益处到中性或小幅度负面效果不等。文章指出,AI系统在现实临床环境中的有效性和成本效益还需要进一步评估。
重点关注
Figure 1 展示了人工智能(AI)系统如何连接到内镜设备上,并在实时上消化道内镜检查中辅助内镜医师。
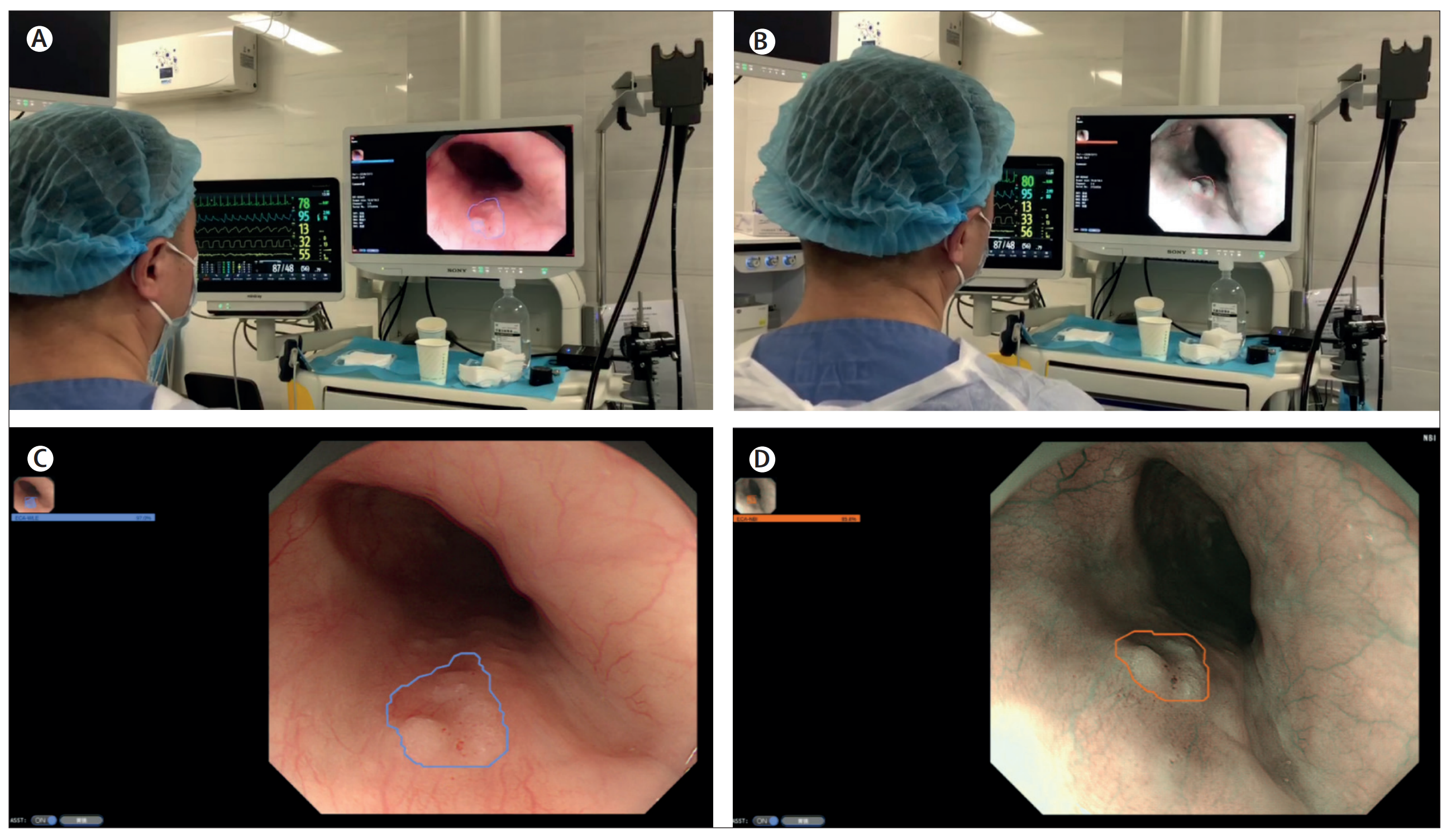
图示分为四个部分 (A, C 和 B, D),分别说明了AI系统在两种不同内镜模式下检测食管高级别上皮内瘤变(high-grade intraepithelial neoplasia,简称HGIN)的能力。
- 在 (A) 和 © 中,AI系统在白光内镜(WLE)下检测到食管的高级别上皮内瘤变。白光内镜是一种常规的内镜检查模式,它使用白光来照亮并观察组织。
- 在 (B) 和 (D) 中,AI系统在非放大窄带成像(NBI)下同样检测到食管的高级别上皮内瘤变。NBI是一种先进的内镜技术,通过使用特定波长的光来增强黏膜表面的细节和血管模式的可视化。
AI系统能够实时地识别出可疑的病变,用多边形标出,并在内镜监视器的左上角显示可疑病变的概率分数。这种实时检测和可视化辅助功能旨在帮助内镜医师更准确地识别和评估食管中的癌前病变或早期癌症,从而提高早期诊断率和治疗的性。
总的来说,Figure 1 强调了AI系统在辅助内镜医师进行精确诊断方面的潜力,特别是在提高对浅表性食管鳞状细胞癌及其癌前病变的检测率方面。通过结合使用WLE和NBI这两种内镜模式,AI系统提供了一种新的工具,可以在不同的内镜检查条件下辅助诊断,有助于改善患者的预后。
三、仅依赖于诊断标签训练AI,大规模筛查巴雷特食管

文献概述
这篇文章是关于使用
弱监督深度学习技术在组织病理学中大规模筛查巴雷特食管(Barrett’s esophagus, BE)的研究。
巴雷特食管是食道腺癌(esophageal adenocarcinoma, EAC)的癌前状况,及时检测可以提高患者的生存率。
目前,CytospongeTFF3测试是一种非内镜的微创程序,用于诊断巴雷特食管中的肠上皮化生(intestinal metaplasia, IM),但它依赖于病理学家对H&E染色和免疫组化生物标记TFF3的评估。这种资源密集型的临床工作流程限制了在高危人群中进行大规模筛查。
为了提高筛查能力,研究者提出了一种基于深度学习的方法,直接从常规H&E染色切片中检测巴雷特食管。这种方法仅依赖于诊断标签,消除了昂贵的局部专家注释的需求。
研究者在两个临床试验数据集上训练并独立验证了他们的方法,总共涉及1866名患者。在发现和外部测试数据集上,H&E模型的AUROC(接受者操作特征曲线下面积)分别达到了91.4%和87.3%,与TFF3模型相当。研究者提出的半自动化临床工作流程可以将病理学家的工作量减少到48%,而不会牺牲诊断性能,使病理学家能够优先处理高风险病例。
文章还讨论了早期癌症检测的重要性,以及如何通过深度学习提高筛查覆盖率。研究者使用了一种基于多实例学习(MIL)范式的弱监督深度学习方法,利用现有的数据集和病理学家的常规诊断报告进行训练,包括同一患者的多个相邻切片的标签。这种方法可以扩展到更大的样本量,以训练更有效和健壮的深度学习模型。
研究者还进行了模型输出的定性、定量和故障模式分析,以确保模型的可解释性,并提出了两种半自动化的机器学习辅助临床工作流程,可以显著减少病理学家的手动工作量,而不会损失诊断性能。
最后,文章通过外部数据集验证了训练模型的泛化能力,并讨论了将深度学习模型整合到当前临床工作流程中的潜力,以及如何通过半自动化工作流程减少病理学家的工作量,使他们能够专注于高风险病例,从而促进巴雷特食管的大规模筛查。
此外,这种方法不需要额外的努力来创建局部专家注释,意味着未来的模型可以随着新的诊断数据的生成而不断实时训练,会导致训练模型性能的进一步提高。
重点关注
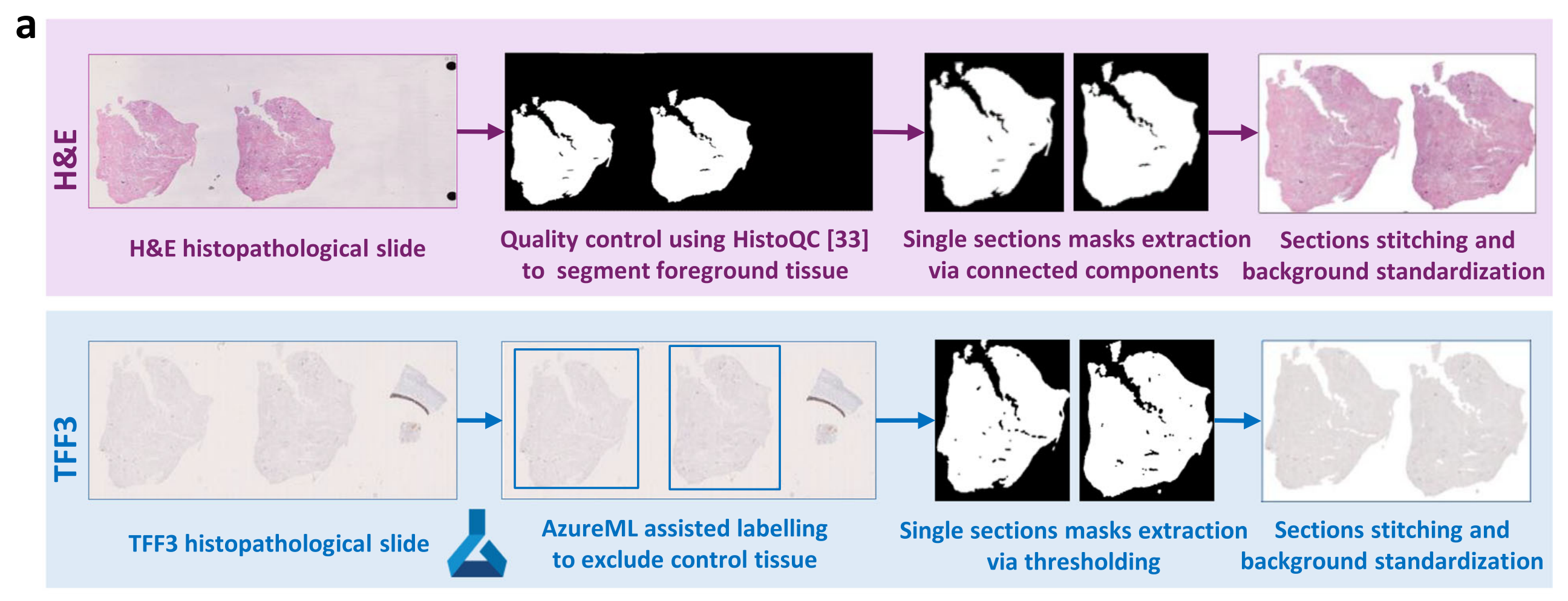
Fig. 1 提供了从H&E(苏木精-伊红染色)和TFF3染色的组织病理学切片中自动检测巴雷特食管(BE)的方法概览,包括数据集预处理、模型训练以及研究中使用的数据。
该方法分为以下几个步骤:
-
切片扫描与预处理:
- a部分说明H&E和TFF3染色的组织病理学切片是从相邻的组织切片扫描得来的。
- 针对H&E和TFF3染色,分别使用不同的预处理流程,这些流程分别用紫色和蓝色的框表示。
-
预处理流程:
- H&E染色的切片预处理包括去除如气泡、阴影、笔迹等不希望的伪影,标准化背景效果,并从TFF3染色的切片中去除控制组织。
- TFF3染色的切片预处理涉及低染色对比度的改善,以及自动或半自动的方式来获取组织区域的前景掩膜。
-
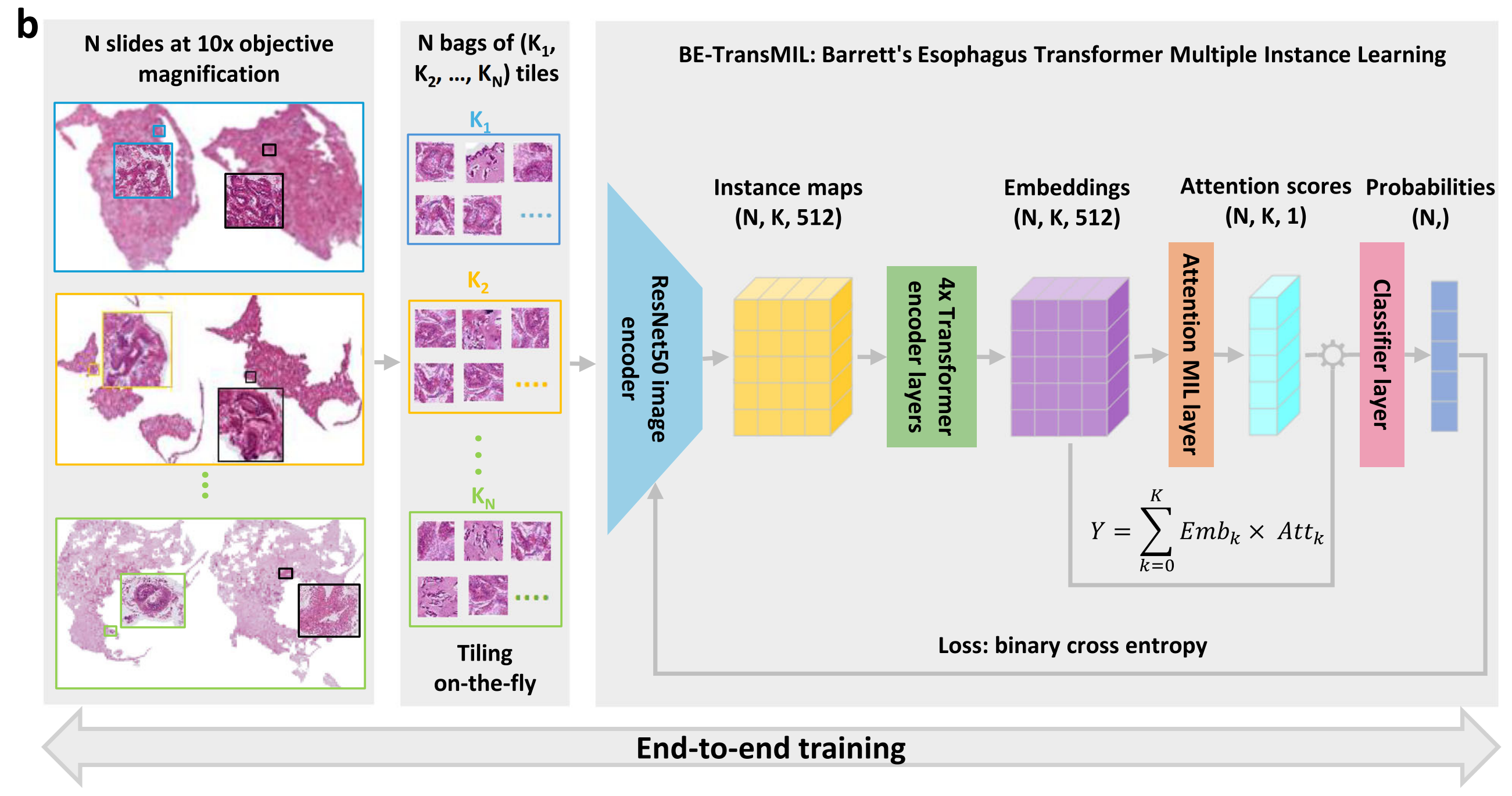
切片分割:
- b部分描述了预处理后的切片会在运行时被动态分割成不重叠的小图块(tiles),这些小图块用于后续的模型训练。
-
模型训练:
- 使用弱监督学习(weakly supervised learning)的BE-TransMIL模型,分别从H&E和TFF3染色的切片中端到端(end-to-end)训练。
- 两种染色的切片采用类似的训练过程,意味着它们会遵循相同的训练协议和参数。
-
模型训练细节:
- 模型训练时,会使用来自全切片图像(whole-slide images, WSIs)的图块。
- 由于单个切片的像素数量巨大(达到千兆像素级别),无法一次性处理整个切片,因此需要将其分割成小块以便计算机视觉编码器处理。
-
模型架构:
- 模型架构包括特征提取器(用于将每个图像图块编码为低维特征图)、依赖性模块(用于捕获切片中各个图块之间的空间依赖性)、注意力MIL池化模块以及全连接分类器层。
-
训练与推理:
- 在训练期间,由于GPU内存大小的限制,只有切片的一个子集(K个图块)被用来训练。
- 在评估时,使用切片中的所有前景组织图块来计算模型输出。
Fig. 1 展示了一个自动化的流程,从原始的染色切片到分割和训练深度学习模型,最终用于检测巴雷特食管。这个过程减少了对专家手动注释的依赖,并且提高了病理诊断的效率和可扩展性。
四、多组学数据,预测食管癌患者对新辅助放化疗反应的标志物

文献概述
这篇文章是关于
食管癌新辅助放化疗(NCRT)治疗反应的多组学方法研究,旨在发现和总结预测食管癌对NCRT反应的生物标志物。
文章首先指出NCRT后手术是可手术的局部晚期食管癌的标准治疗策略,并强调了病理完全缓解(pCR)与生存结果显著改善的关联。然而,pCR的比率在食管腺癌(EAC)和食管鳞癌(ESCC)患者中并不高,因此迫切需要改进的生物标志物来预测研究和临床环境中的EC放化疗反应。
文章进一步讨论了高通量技术(如下一代测序)在发现新的预测生物标志物方面的进展,特别是基于多组学数据,包括基因组/转录组测序和蛋白质组/代谢组质谱。多组学数据的应用已经显示出在改善对EC NCRT敏感性/抗性潜在机制的理解方面的好处。特别是,人工智能(AI)的显著发展为癌症研究引入了新的方向。多组学数据的整合显著推进了我们对疾病的认知,并促进了从不同维度水平预测治疗反应的有价值生物标志物的识别。
研究总结了多组学技术在预测EC患者NCRT反应中的当前状态,并讨论了这些多组学平台的当前限制、挑战和未来展望,以协助实验设计和临床使用,进行进一步的综合分析。
文章的其余部分详细讨论了以下内容:
基因组预测NCRT反应转录组预测NCRT反应蛋白质组预测NCRT反应代谢组预测NCRT反应放射组预测NCRT反应多组学数据组合成“整合组学”- 多组学分析中的
人工智能 - 多组学面临的
挑战和未来方向
最后,文章得出结论,随着“组学时代”的到来,技术进步和成本降低将使得收集和整合不同层面的分子数据成为。尽管需要进行确认性实验和验证,但多组学方法在EC患者管理中的临床应用有明确的路径。未来几年中,大量的高通量组学研究将提供独特的机会,揭示潜在的精准肿瘤学应用的分子机制,并为NCRT分层患者。
重点关注
Fig. 1 展示了基于多组学数据的人工智能辅助食管癌患者治疗选择的新兴作用。
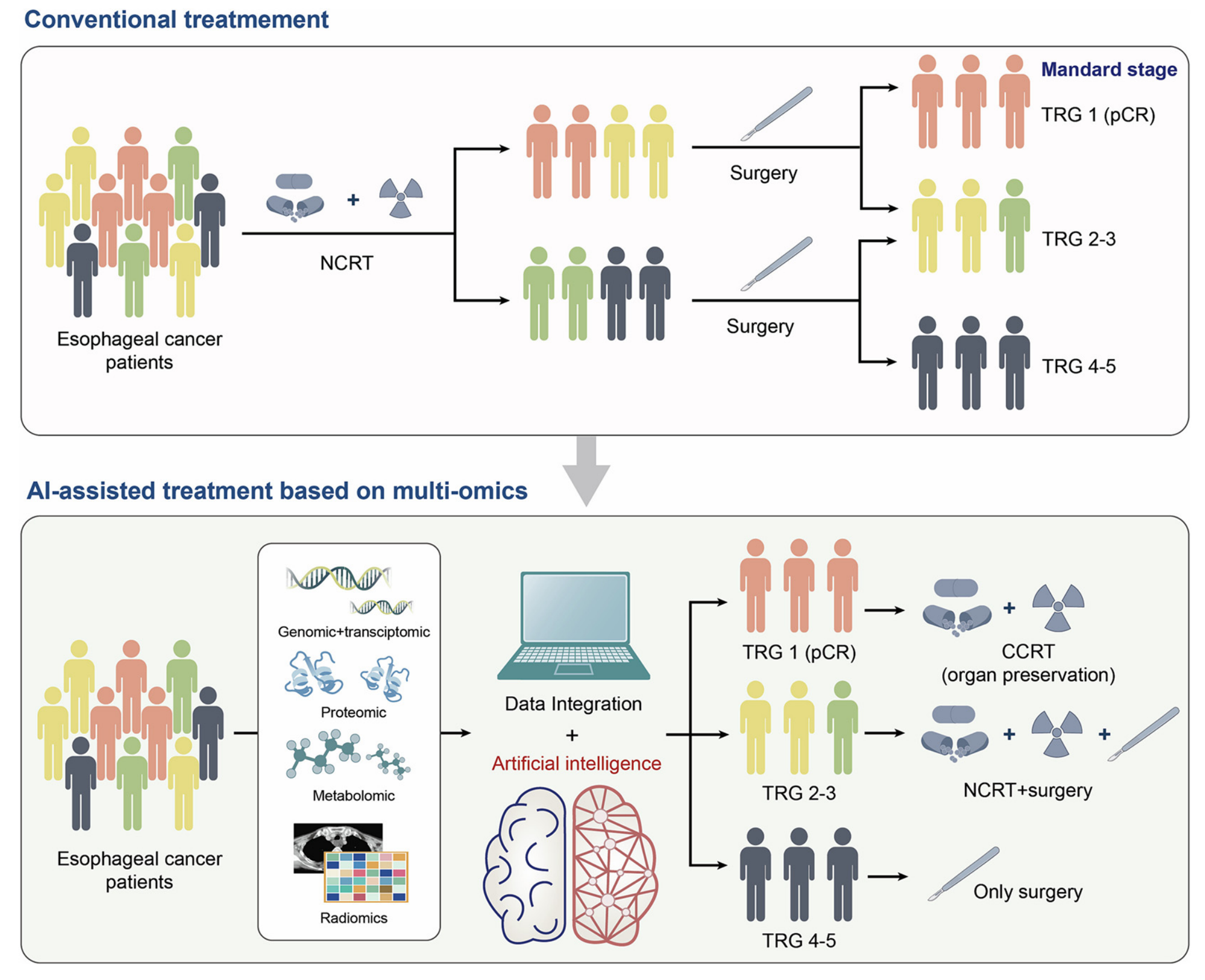
这张图包含了以下几个关键要素:
-
多组学数据整合:展示了如何从基因组、转录组、蛋白质组、代谢组和放射组等不同组学层面收集数据,并将其整合用于分析。
-
人工智能(AI)的应用:描述了人工智能技术,特别是机器学习和深度学习,如何被应用于分析这些复杂的多组学数据。
-
治疗选择:阐释了AI如何帮助医生根据患者的多组学数据来选择最合适的治疗方案。
-
预测模型:包括了AI算法如何建立预测模型,以预测不同治疗方案对特定患者的效果。
-
个性化医疗:图示强调了如何通过分析患者的多组学数据来实现个性化或精准医疗。
-
临床决策支持:展示了AI如何辅助临床决策,通过提供基于数据的见解来帮助医生做出更准确的治疗决策。
-
生物标志物的发现和验证:描述了AI在识别和验证预测治疗反应的生物标志物中的作用。
-
治疗反应监测:阐释了AI如何帮助监测患者对治疗的反应,并在必要时调整治疗方案。
-
数据可视化:图示包含了数据的可视化表示,帮助理解多组学数据与治疗反应之间的关系。
-
未来方向:指出了AI在多组学数据分析中的未来发展,包括算法改进、数据集成技术和新的生物标志物发现。
五、AI赋能“磁共振+质谱”,揭示特征性代谢组图谱并优化食管鳞状细胞癌的早期检测

文献概述
这篇文章是一项关于食管鳞状细胞癌(ESCC)早期检测的研究,标题为“NMR和MS揭示特征性代谢组图谱并优化食管鳞状细胞癌的早期检测”。研究由Yan Zhao、Changchun Ma、Rongzhi Cai等作者共同完成,并发表在《Nature Communications》上。
研究背景:
食管癌(EC)是一个全球性的重大公共卫生问题,尤其在中国,超过全球年发病率和死亡率的一半。由于早期症状不明显以及缺乏早期诊断的生物标志物,大多数患者在晚期才被诊断,导致5年生存率仅为21%。
目前诊断ESCC的标准方法依赖于内窥镜结合组织病理学,但这种方法具有侵入性,降低了患者的依从性。因此,迫切需要开发可靠、非侵入性、易于获取且负担得起的ESCC早期检测工具。
研究方法和发现:
研究团队采用了核磁共振(NMR)和质谱(MS)技术,对来自三家医院的560名参与者的1,153个匹配的ESCC组织、正常粘膜、术前和术后一周的血清和尿液样本进行了代谢组学分析。
通过机器学习和加权基因共表达网络分析(WGCNA),研究发现**“丙氨酸、天冬氨酸和谷氨酸代谢”在ESCC发展过程中普遍存在异常,并且在16个血清和10个尿液代谢特征中得到一致的识别**。
研究结果:
NMR基础的简化小组,包括任何五个血清或尿液代谢物,表现出比临床血清肿瘤标志物更高的性能(AUC分别为0.984和0.930),并且在测试集中有效地区分了早期ESCC(血清准确度=0.994,尿液准确度=0.879)。
研究结果表明,基于NMR的生物流体筛查可以揭示ESCC的特征性代谢事件,并且对于早期检测是可行的。
研究意义:
这项研究为ESCC的早期诊断提供了新的生物标志物,并展示了一种基于NMR的生物流体筛查方法,这种方法不仅能够准确反映组织代谢变化的特征,而且还具有足够的临床敏感性,可用于ESCC的早期诊断和筛查。这对于改善ESCC患者的治疗结果和提高生存率具有重要意义。
重点关注
图1展示了整体研究设计的框架图。在这个研究中,共有来自三个中心的560名参与者。

研究过程如下:
- 样本收集:从所有参与者那里收集了组织、血清和尿液样本。
- 代谢组学分析:
- 1H-NMR:即质子核磁共振,一种分析生物样本中代谢物的技术。
- MS-based metabolomics:基于质谱的代谢组学,另一种用于代谢物分析的技术。
- 数据分析:
- Pattern recognition:模式识别,用于在数据中识别和分类不同的模式或特征。
- Machine learning:机器学习,应用算法和统计模型让计算机系统利用数据来做出预测或决策。
- WGCNA:加权基因共表达网络分析(Weighted Gene Co-expression Network Analysis),一种用于描述基因集之间关系的系统生物学方法,虽然最初是为基因表达数据设计的,但也可适用于代谢物数据。
整个研究设计的目的是通过综合使用1H-NMR和MS技术来分析生物样本,然后利用模式识别、机器学习和WGCNA等分析方法来揭示食管鳞状细胞癌(ESCC)的代谢特征,并优化早期检测方法。通过这种多中心、多平台的研究方法,研究者能够更全面地理解ESCC的代谢变化,并识别出用于早期诊断的生物标志物。
六、利用电子健康记录训练AI,预测食管腺癌和胃贲门腺癌的发生

文献概述
这篇文章是关于使用机器学习来预测
食管腺癌(EAC)和胃贲门腺癌(GCA)的发生。
研究者们开发了一个名为Kettles Esophageal and Cardia Adenocarcinoma predictioN (K-ECAN)的工具,该工具利用电子健康记录(EHR)数据来指导筛查决策。
以下是文章的主要内容概括:
背景与目的:
- 自1970年代以来,食管腺癌的发病率增长了6倍。
- Barrett食管(BE)是EAC的可见前期病变,可通过上消化道内窥镜检查发现。
- EAC和BE的风险因素包括男性、老年、腹部肥胖、吸烟和胃食管反流病(GERD)症状。
- 上消化道内窥镜检查与降低EAC患者的死亡率有关,并能识别可治疗的BE。
方法:
- 研究者们访问了美国退伍军人健康管理局(VHA)企业数据仓库,以识别2005年至2018年间有1次或多次就诊的退伍军人。
- 在VHA中央癌症登记处识别出被诊断为EAC或GCA的患者,并与10,256,887名对照组进行了比较。
- 预测因素包括在指数日期前1至5年之间的人口统计特征、处方、实验室结果和诊断。
- 使用简单的随机抽样插补和极端梯度提升(一种机器学习方法)开发并内部验证了K-ECAN工具。
结果:
- K-ECAN具有良好的校准度,并比以前验证的模型(如Nord-Trøndelag健康研究和Kunzmann模型)有更好的区分度(接收者操作特征曲线下面积[AuROC]为0.77)。
- 仅使用指数日期前3至5年的数据会略微降低其准确性(AuROC为0.75)。
- 在模拟非VHA人群时,通过下采样男性,Nord-Trøndelag健康研究和Kunzmann模型的AUC有所提高,但K-ECAN仍然是最准确的(AuROC为0.85)。
- 尽管胃食管反流病与EAC强烈相关,但它对预测信息的增益贡献很小。
结论:
- K-ECAN是一个新颖的内部验证工具,使用电子健康记录数据预测EAC和GCA的发生。
- 需要进一步的工作在VHA之外验证K-ECAN,并评估如何在电子健康记录中最佳实施它。
文章还讨论了K-ECAN工具的开发过程,包括数据预处理、机器学习模型的训练与调整,以及对模型准确性的测试和验证。此外,还探讨了K-ECAN工具在不同性别和种族中的准确性,并与现有的临床模型和筛查指南进行了比较。最后,文章强调了K-ECAN工具在电子健康记录系统中实时使用的潜力,并提出了未来研究的方向。
重点关注
Figure 2 在文章中提供了 K-ECAN 工具与其他已发布指南和验证模型在预测
食管腺癌(EAC)和胃贲门腺癌(GCA)方面的比较。
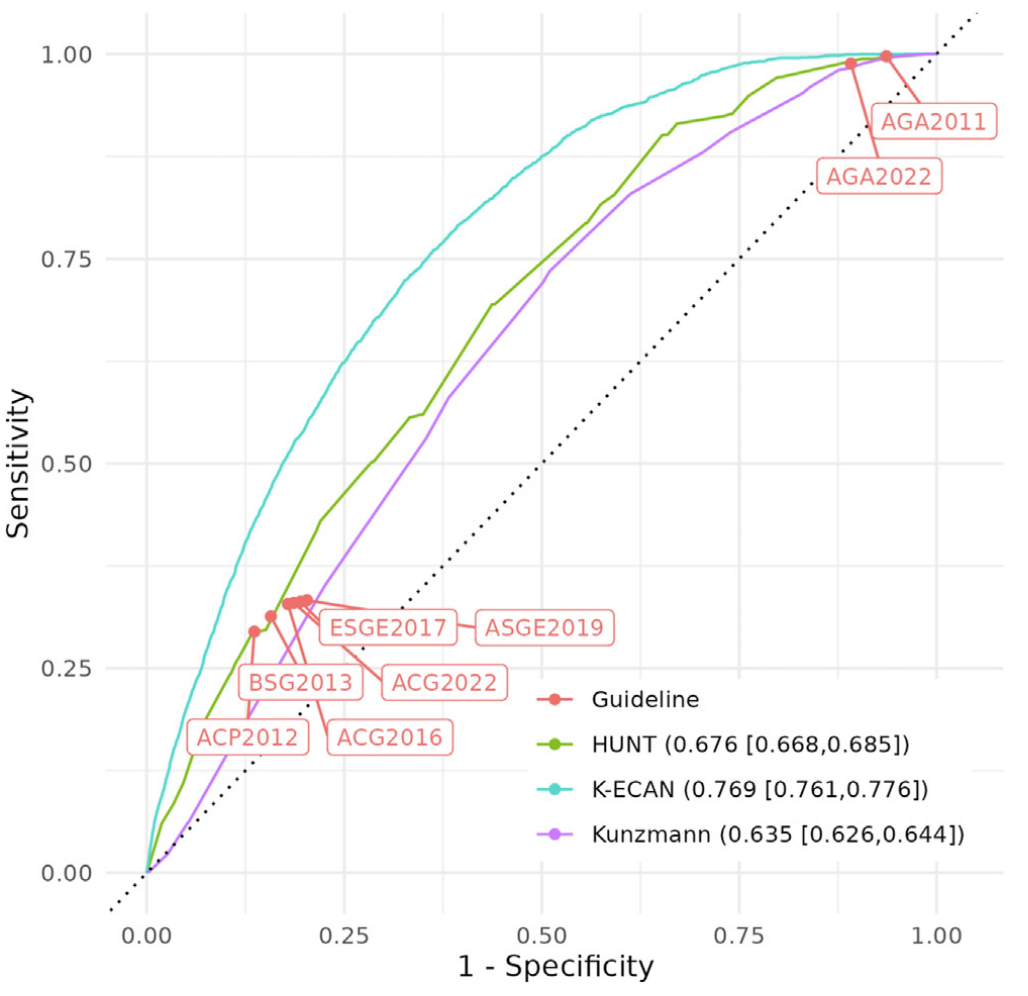
图中展示了每个模型的敏感性、特异性以及接收者操作特征曲线下面积(AuROC),并给出了95%置信区间(CI)。
-
敏感性(Sensitivity): 敏感性是指筛查工具正确识别
患病个体的能力。敏感性越高,漏诊的性越低。 -
特异性(Specificity): 特异性是指筛查工具正确识别
未患病个体的能力。特异性越高,误诊的性越低。 -
AuROC: 接收者操作特征曲线下面积(Area under the Receiver Operating Characteristic curve)是一个综合指标,用来衡量模型整体的预测能力。AuROC 值越高,模型的预测性能越好。完美的模型 AuROC 为 1.0。
-
95% CIs: 95% 置信区间表示对模型性能的估计有一定的不确定性。CI 越窄,表示对模型性能的估计越精确。
-
不同组织发布的指南: 图中提到了多个组织发布的指南,如美国胃肠病学院(ACG)、美国内科医师学会(ACP)、美国胃肠病学会(AGA)、美国胃肠内镜学会(ASGE)、英国胃肠病学会(BSG)和欧洲胃肠内镜学会(ESGE)。
-
分析数据集: 所有分析使用的是研究中保留的25%的数据作为测试集。这意味着在模型开发和初步验证之后,剩余的25%数据被用来进行最终的测试,以评估模型在未见过的数据上的表现。
-
K-ECAN 与其他模型的比较: 根据图示,K-ECAN 工具的 AuROC 应该被与其他模型的 AuROC 进行比较,以确定哪个模型具有更好的预测能力。同时,敏感性和特异性的比较也很重要,因为一个理想的筛查工具应该既有高敏感性也有高特异性。
这篇关于顶刊速递·人工智能在食管癌领域最新进展|24-06-05的文章就介绍到这儿,希望我们推荐的文章对编程师们有所帮助!







