本文主要是介绍人工智能与【肿瘤免疫微环境】结合,探索免疫治疗的新方向|24年6月·顶刊速递·06-02,希望对大家解决编程问题提供一定的参考价值,需要的开发者们随着小编来一起学习吧!
罗小罗同学·说
24-06-02|文献速递
今天分享的文章,主题是——人工智能&肿瘤免疫微环境。解释一下这张图,左列是文献标题,右侧是发表的年月,放心,都是顶刊,不然我也不会选的。
PS:如果一直看我推文的同学/老师,你们会发现有些文章在之前的肿瘤专题中出现过(例如第二篇和第三篇),就当加深印象咯。

24-06-02|小罗日报|共耗时67min

交流群
欢迎大家来到【医学AI】交流群,本群设立的初衷是提供交流平台,方便大家后续课题合作。
公众号发表的文章会分享到群里,学术会议和比赛也会不定期分享,欢迎组队参与和线下交流!!
最后再介绍一下小罗自己:课题组位于广州,专业方向是医学人工智能,研究内容主要是病理组学,目前已借助自媒体与华盛顿大学、北大、北航、华科、北科、南方医等院校的课题组建立了联系,欢迎更多的人加入我们的队伍!!
(PS:目前建立联系的同学太多了,院校列不过来了,所以也就懒得改了,还请见谅,哈哈)

一、AI赋能空间转录组分析,探讨前列腺癌的异质性与肿瘤微环境之间的关系

文献概述
这篇文章是一项关于前列腺癌(Prostate Cancer, PCa)的研究,标题为《Integration Analysis of Single-Cell Multi-Omics Reveals Prostate Cancer Heterogeneity》,作者为Xiaojie Bian等人,发表在《Advanced Science》期刊上。研究主要探讨了前列腺癌的异质性,以及肿瘤微环境中肿瘤细胞与基质细胞之间的相互作用。
关键点概括如下:
-
研究背景:
前列腺癌是全球男性最常见的恶性肿瘤之一,具有高度的异质性。肿瘤微环境中的细胞生态系统复杂,但目前对这种异质性如何被肿瘤和基质细胞塑造的了解还很有限。 -
研究方法:研究者整合了来自
前列腺癌患者和健康对照组的单细胞RNA测序、空间转录组学和大量ATAC测序数据。 -
主要发现:
- 识别了一个标记为SOX9highARlow的
干细胞亚群,这个亚群在新辅助去势治疗(ADT)后显著富集。 - 发现恶性前列腺癌患者中,作为效应T细胞的CD8+CXCR6+ T细胞亚群显著减少。
- 利用机器学习和计算智能对前列腺癌细胞的细胞多样性和细胞间通信进行了
空间转录组分析。 - 检查了巨噬细胞和中性粒细胞在癌症进展过程中的状态转变。
- 高级别前列腺癌中的免疫抑制微环境与调节性T细胞(Tregs)的浸润有关,这可能是由FAP+成纤维细胞亚群诱导的。
- 识别了一个标记为SOX9highARlow的
-
结论:研究揭示了前列腺癌微环境中细胞异质性的阶段特异性,并阐明了它们与疾病进展的相互交流,这对于促进前列腺癌的诊断和治疗可能有用。
-
研究意义:这项研究提供了对前列腺癌异质性的深入理解,并可能有助于开发新的诊断和治疗方法。
知识点补充
去势治疗
去势治疗是一种消除性内分泌治疗手段,目的是降低或阻断激素对肿瘤的作用,抑制肿瘤的生长。临床上去势治疗手段主要有外科手术去势、放疗去势和药物去势三种。
1.手术去势
对乳腺癌患者切除双侧卵巢,对前列腺癌患者切除双侧睾丸。手术去势的优势是彻底阻断卵巢来源的雌激素或睾丸来源的雄激素,缺点是不可逆,且有手术创伤。
2.放疗去势
可避免切除卵巢,因照射剂量低,因此基本无创,但治疗周期较长,疗效不如手术去势彻底,目前临床上已不再常规应用。
3.药物去势
促性腺激素释放激素类似物通过负反馈作用于下丘脑,抑制下丘脑产生促性腺激素释放激素。药物去势是在保留睾丸或卵巢的前提下,通过药物降低血清睾酮或雌激素水平,达到去势的目的。
药物去势具有与手术去势相似的疗效,克服了手术去势与放疗去势的缺点,因此更安全,且停药后可逆,患者的生活质量更好,是目前临床最常采用的去势治疗方法。
ATAC-Seq
ATAC-Seq的全称是Assay for Transposase Accessible Chromatin using sequencing,中文译为染色体可及性测序。是利用Tn5转座酶切割染色质的开放区域并标记DNA序列,结合二代测序来获得相应基因的信息。
最早是由斯坦福大学的William J. Greenleaf和Howard Y. Chang在2013年发表在Nat Methods杂志上(Transposition of native chromatin for multimodal regulatory analysis and personal epigenomics),研究者当时使用ATAC-seq来识别开放染色质区域,识别调控区域中的核小体结合和核小体不结合的位置。
看到上面的信息,我们不禁产生一个疑问,就是**为什么要研究染色质的开放区域?**我们知道真核生物的遗传物质是染色体,染色体的基本结构单位是核小体,正常情况下染色体是螺旋缠绕在一起的,DNA的活动就会受到限制。
如果DNA想复制或者转录就需要先把螺旋打开,这样相关的酶才能结合到DNA上面发挥各自的功能。而螺旋打开的这一部分就被称为开放的染色质,这一部分可以让各种调控因子等结合上去,所以称为染色质的可及性。研究这一部分我们就可以知道发生转录的DNA区域,所以具有重要的意义。
二、肿瘤微环境+人工智能:从六个细胞亚群预测肝细胞癌患者的预后

文献概述
这篇文章是一项关于
肝细胞癌(HCC)的综合分子分类研究,旨在预测HCC患者的肿瘤微环境(TME)特征、预后和治疗反应。
研究团队由Yihong Chen、Xiangying Deng、Yin Li、Ying Han、Yinghui Peng、Wantao Wu、Xinwen Wang、Jiayao Ma、Erya Hu、Xin Zhou、Edward Shen、Shan Zeng、Changjing Cai、Yiming Qin和Hong Shen组成,他们来自中国中南大学湘雅医院肿瘤科、老年疾病国家临床研究中心、加拿大麦克马斯特大学生命科学系以及中南大学湘雅医院脊柱外科和骨科。
研究的核心内容包括:
- 单细胞数据集整合:研究者整合了
三个单细胞数据集,以描述HCC的TME特征,并识别了六个与预后相关的细胞亚群。 - 无监督聚类:通过
无监督聚类分析,基于亚群特异性标记物的表达,研究者生成了五种转录组亚型。 - 预后和治疗反应的预测价值:研究探索了这些分子亚型在多个外部HCC队列和湘雅HCC队列中对预后和治疗反应的预测价值。
- TME特征估计:使用单细胞免疫谱测序、质谱细胞术(CyTOF)和多重免疫荧光(mIF)来估计TME特征。
- 预后相关评分(PRS)构建:基于机器学习算法构建了PRS。
研究结果揭示了:
五种转录组亚型具有不同的临床预后、肿瘤干细胞特性、免疫景观和治疗反应。- 第1类表现出炎症表型和较好的临床结果,而第2类和第4类特征为缺乏T细胞浸润。
- 第5类和第3类指示抑制性的肿瘤免疫微环境。
- 对多种治疗队列的分析表明,第5类和第3类对免疫检查点阻断(ICB)和靶向治疗敏感,而第1类和第2类对经动脉化疗栓塞(TACE)治疗反应更好。
- 第4类对所有常规HCC治疗均表现出抗性。
- 研究还为高PRS HCC患者进一步鉴定了三种潜在治疗药物和四个靶标。
结论是,该研究生成了一个临床有效的分子分类,以指导HCC患者的精准医疗。
三、癌症患者的个体化治疗新视角|外周血免疫细胞揭示个体的疾病状态或对特定治疗的反应

文献概述
这篇文章报道了一种基于机器学习平台的临床免疫分析方法,该方法利用简单的血液测试来揭示反映个体免疫系统的细胞组成。
研究团队通过多参数流式细胞术和大量RNA测序技术,对健康捐赠者和晚期癌症患者的外周血免疫细胞异质性进行了表征。他们识别出五种具有独特细胞类型分布和基因表达特征的免疫类型(immunotypes),并发现这些免疫类型在多种不同的诊断中是保守的。
研究的关键点包括:
- 开发了一个基于机器学习的临床免疫分析平台。
- 使用多参数流式细胞术和大量RNA测序技术来描述免疫状态。
- 识别并验证了五种跨不同诊断保守的免疫类型。
- 通过简单的血液测试,有潜力在临床上用于分层治疗反应。
研究还发现,这些免疫类型与癌症患者的治疗反应有关,可以预测对特定治疗的反应,从而为癌症患者提供了潜在的临床应用价值。通过对17,800个公开的转录组进行独立分析,研究结果得到了证实。此外,研究还开发了基于免疫类型的签名分数,这些分数与患者对不同癌症治疗的反应相关,包括免疫治疗,具有预后和预测的相关性。
这项研究由Daniiar Dyikanov, Aleksandr Zaitsev, Tatiana Vasileva等作者完成,并发表在《Cancer Cell》杂志上。研究的通讯作者是Michael F. Goldberg,来自BostonGene公司。研究结果强调了通过外周血简单测试来评估个体的疾病状态或对特定治疗的反应的潜力,为癌症患者的个体化治疗提供了新的视角。
重点关注
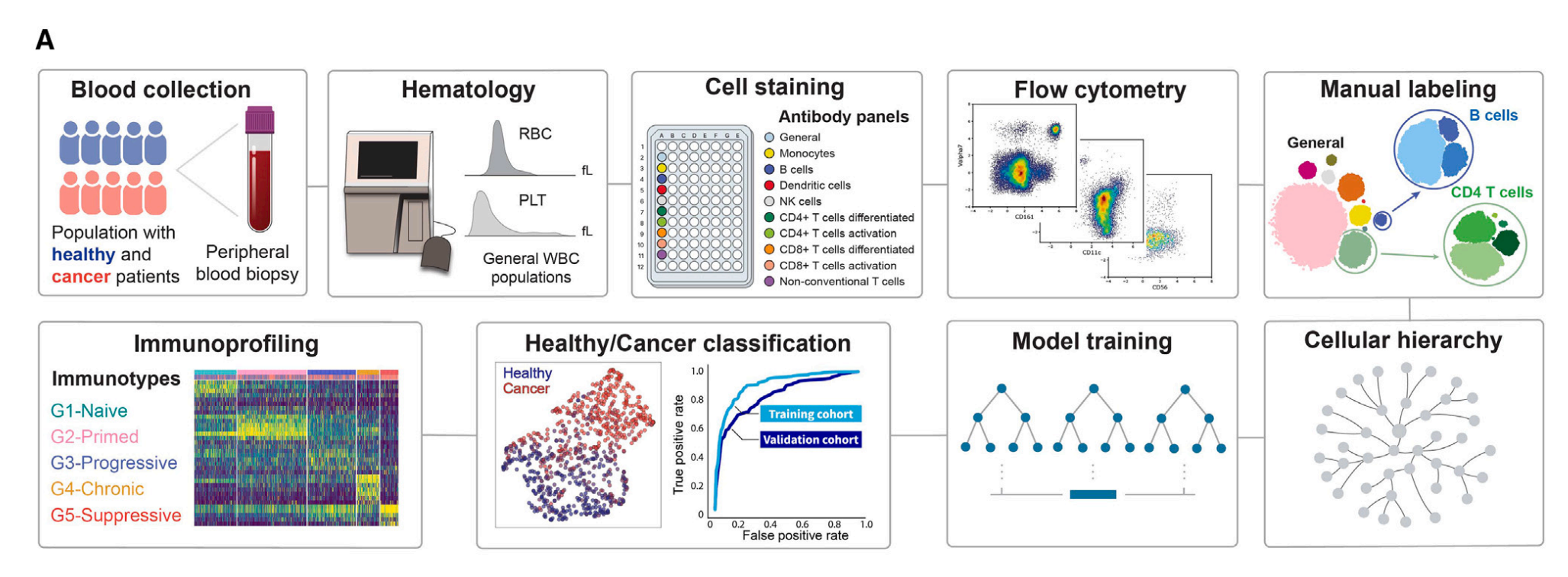
Figure 1展示了免疫分析流程(immunoprofiling pipeline)的开发,这一流程旨在通过外周血样本来评估个体的免疫状态,并区分健康捐赠者和癌症患者。
以下是对图中各个部分的分析:
(A) 免疫分析流程的开发:
- 从健康捐赠者和癌症患者的外周血样本中分离出白细胞(WBCs)。
- 使用血液分析仪测量完整的血细胞计数。
- 在96孔板中,使用定制的抗体组对WBCs进行染色。
- 通过多参数流式细胞术处理WBCs。
- 手动标记的流式细胞术数据用于训练机器学习模型,以自动识别细胞群体。
- 最终实施了健康/癌症和免疫类型的分类。
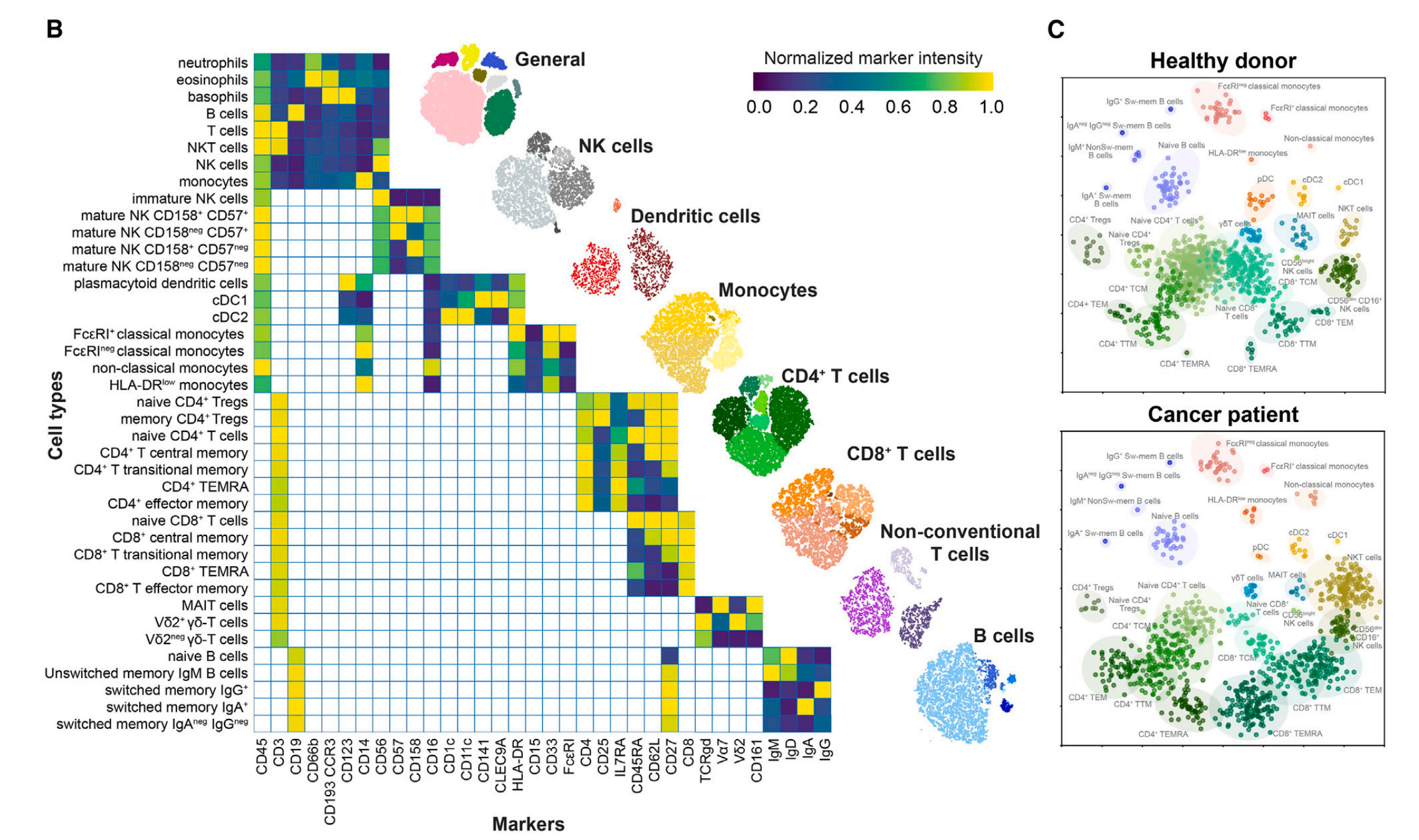
(B) 流式细胞术面板的示意图热图:
- 热图展示了使用的标记物(x轴)和已识别群体(y轴)的一部分。
- 热图显示了通过不同抗体组(例如,通用、NK细胞和树突细胞)组合得到的细胞表面标记的标准化信号强度,这些标记定义了特定的细胞类型。
- 右侧展示了使用该策略识别的免疫细胞家族的代表性tSNE(t-分布随机邻域嵌入)图。
© 基于细胞群体的免疫状态差异:
- 使用极坐标图展示了健康捐赠者和癌症患者之间免疫状态的差异。
- 每个点代表外周血单核细胞(PBMCs)所有分数的0.5%,共展示了200个分数。
- 图形化地展示了健康个体和癌症患者之间在不同免疫细胞群体上的相对频率差异。
此外,文中提到了查看其他补充图(Figures S1, S2)和补充表格(Tables S1, S2, S3)以获取更多信息。这些补充材料可能包含了关于实验设计、数据收集、分析方法和额外结果的详细信息。
整体来看,Figure 1描述了一个综合的免疫分析流程,从样本收集到数据解释,旨在通过血液测试来揭示个体的免疫特征,并将其应用于区分健康和疾病状态,特别是癌症。
四、肿瘤免疫的双重刃:揭秘三级淋巴结构的抗癌与助癌之谜

文献概述
这篇文章是关于三级淋巴结构(Tertiary Lymphoid Structures, TLS)在肿瘤免疫中的作用和其在临床应用前景的综述。
文章详细讨论了TLS的形成、成熟、以及它们在肿瘤微环境中的异质性。TLS是类似于二级淋巴器官的免疫细胞群聚,它们在非淋巴组织中形成,并在慢性炎症条件下,包括癌症、慢性感染和自身免疫疾病中显著表现。
文章指出,TLS通常与大多数癌症类型中的抗肿瘤免疫反应相关,但也可能表现为促肿瘤免疫反应。TLS功能的异质性很大程度上取决于肿瘤浸润性淋巴细胞(Tumor-Infiltrating Lymphocytes, TILs)的组成以及肿瘤相关TLS(Tumor-Associated Tertiary Lymphoid Structures, TA-TLS)中细胞亚群的平衡。成熟度和/或密度较高的TLS通常与有利的临床结果和免疫治疗反应相关,这主要是由于TA-TLS中不同比例的免疫细胞亚群之间的交流。
此外,文章还强调了开发有效的成像和诱导方法来研究TA-TLS对于增强抗肿瘤免疫的重要性。结合纳米探针、水凝胶和人工智能(AI)等生物材料的成像技术,可以非侵入性地体内可视化TLS。文章探讨了不同表型的T和B细胞亚群之间的动态相互作用,这些相互作用有助于TLS的结构和功能多样性,并检视了现有的和新兴的TLS成像和诱导技术,特别关注癌症免疫疗法和生物材料。
文章还强调了正在探索的TLS新治疗方法,目的是提高免疫检查点阻断(Immune Checkpoint Blockade, ICB)治疗的疗效和预测预后。
五、综述|乳腺导管原位癌(DCIS)向浸润性乳腺癌(IDC)的发展研究

文献概述
这篇文章是一篇关于
乳腺导管原位癌(DCIS)向浸润性乳腺癌(IDC)发展的综述文章。
DCIS是一种非侵袭性乳腺癌,占新诊断乳腺癌的约20%。尽管DCIS通常不被视为生命威胁性疾病,但未经治疗的DCIS中有25-60%可能会发展成IDC。因此,区分非进展性和进展性DCIS对于临床治疗至关重要,但目前这一点仍具有挑战性。
文章首先介绍了DCIS的分类,包括其结构模式和组织病理学核特征,并讨论了DCIS与IDC之间的相似性和差异。DCIS通常被认为是IDC的直接前体,并且与年龄、家族史、乳腺密度和激素治疗等因素共享某些风险因素。
接着,文章深入探讨了乳腺癌中的关键信号通路,如雌激素受体(ER)途径、HER2信号途径、PI3K/AKT/mTOR途径、MAPK途径和cyclin D1/CDK4/6/RB1途径,这些途径在DCIS的起始和进展中可能起着重要作用。
文章还回顾了DCIS和IDC的分子特征,包括比较同步DCIS和IDC、原发性DCIS与复发性DCIS或IDC之间的分子差异。研究表明,同步DCIS和IDC在基因组水平上有很高的一致性,但在某些情况下也发现了它们之间的差异。
此外,文章讨论了DCIS进展到IDC的不同模型,包括独立谱系模型、进化瓶颈模型、多克隆侵袭模型和汇聚表型模型,并强调了肿瘤微环境(TME)在DCIS进展中的重要作用。
文章还总结了用于研究DCIS-IDC的实验模型和先进技术,如单细胞测序、空间转录组学和人工智能等。
最后,文章讨论了DCIS和IDC的临床进展,包括预后生物标志物和临床治疗,旨在促进未来更个性化的治疗策略的发展。研究DCIS已经为乳腺癌的发生提供了重要的见解,并将继续为临床应用铺平道路。
重点关注
Fig. 2 展示了乳腺癌中的关键信号通路。乳腺癌是一种具有多种亚型的异质性疾病。其发展和进展受到亚型特异性和共享信号通路的影响,以及它们之间复杂的交互作用。针对这些关键信号通路的抑制剂已经改善了乳腺癌的预后。
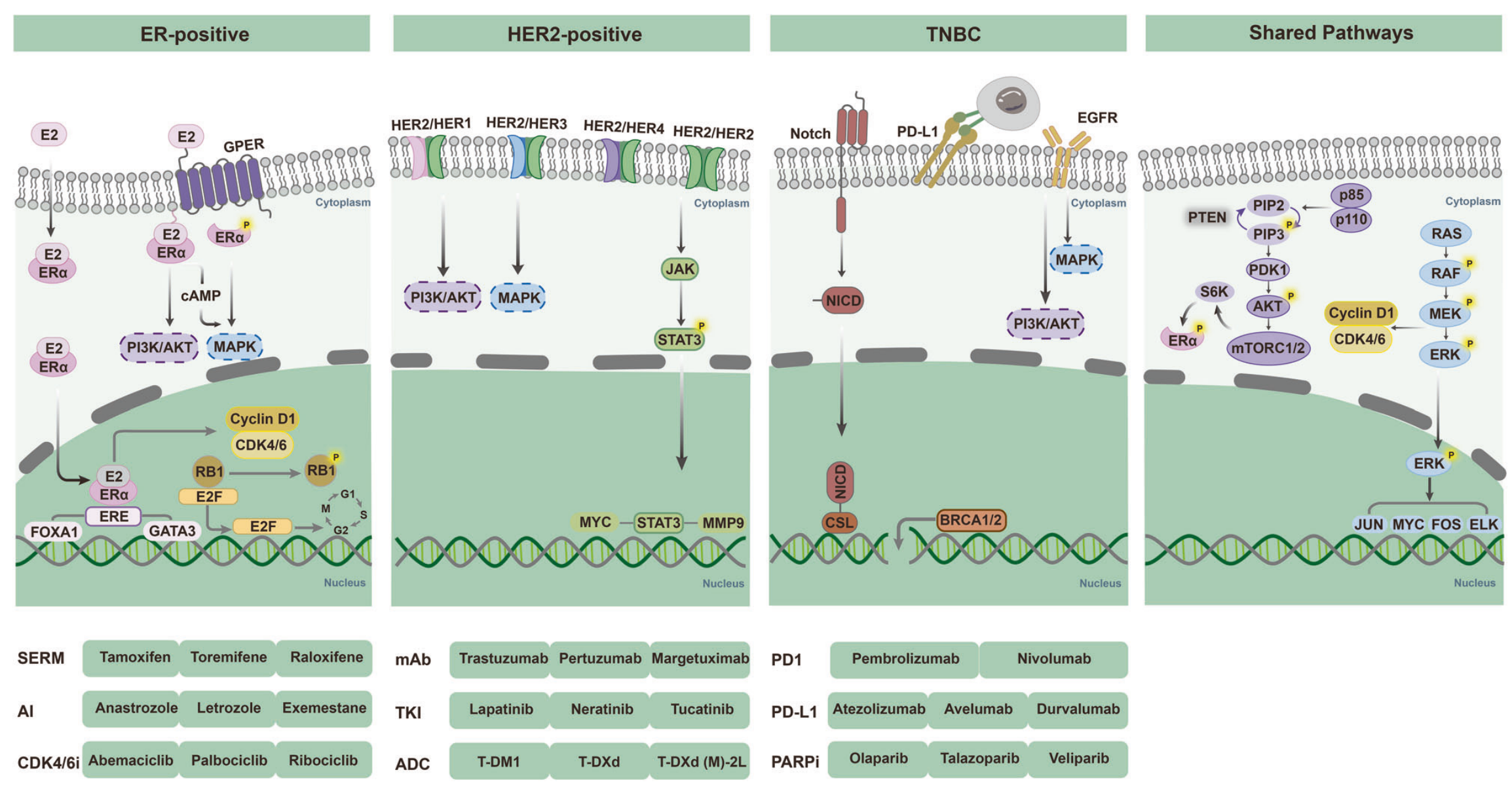
以下是对图示中提到的关键信号通路和相关概念的分析:
-
雌激素受体(ER)途径:ER途径在乳腺癌的发展中起着核心作用,特别是ER阳性乳腺癌。17β-雌二醇(E2)作为主要的雌激素,通过与ER(主要是ERα)结合,激活基因组ER信号通路,促进乳腺癌细胞增殖和减少凋亡。
-
HER2信号通路:HER2(人表皮生长因子受体2)是EGFR家族的成员之一,与HER2阳性乳腺癌的侵袭性表型和不良预后相关。HER2通过形成同源或异源二聚体激活下游信号通路,如PI3K/AKT、MAPK和JAK/STAT,这些通路导致癌细胞增殖、存活、粘附和转移。
-
PI3K/AKT/mTOR途径:PI3K(磷脂酰肌醇3激酶)是细胞内激酶,与AKT和mTOR一起,参与调控细胞生长、存活和代谢。PIK3CA基因突变在ER阳性乳腺癌中较为常见,激活PI3K/AKT/mTOR途径与乳腺癌的发展密切相关。
-
MAPK途径:MAPK(丝裂原活化蛋白激酶)参与控制细胞增殖、应激适应、分化和凋亡等过程。在乳腺癌中,MAPK途径的激活与激素受体的调控、生长因子反应和靶向治疗反应有关。
-
Cyclin D1/CDK4/6/RB1途径:在ER阳性乳腺癌中,cyclin D1/CDK4/6/RB1复合体在细胞增殖中起关键作用。雌激素诱导的cyclin D1表达激活CDK4/6,进而导致RB1的过度磷酸化,推动细胞周期的进展。
-
三阴性乳腺癌(TNBC):TNBC是一种缺乏ER、PR和HER2表达的乳腺癌亚型,通常表现出较高的侵袭性和较差的治疗响应。
-
EGFR:表皮生长因子受体,与HER2一起参与调控细胞增殖和存活。
-
NICD:Notch信号通路的细胞内结构域,参与细胞命运决定和细胞增殖。
-
SERM:选择性ER调节剂,用于治疗ER阳性乳腺癌。
-
AI:芳香酶抑制剂,用于降低体内雌激素水平,治疗ER阳性乳腺癌。
-
CDK4/6i:CDK4/6抑制剂,是近年来乳腺癌治疗的重要进展,特别用于治疗ER阳性乳腺癌。
-
mAb:单克隆抗体,用于靶向特定分子,如HER2。
-
TKI:酪氨酸激酶抑制剂,用于抑制肿瘤细胞的信号传导。
-
ADC:抗体-药物偶联物,将药物直接递送到肿瘤细胞。
-
PARPi:聚(ADP-核糖)聚合酶抑制剂,用于治疗某些类型的乳腺癌,尤其是BRCA突变携带者。
图示强调了这些信号通路在乳腺癌进展中的重要性,并指出针对这些通路的治疗策略已经改善了乳腺癌患者的预后。
六、空间蛋白质组学HIFI技术|在高倍镜下对组织切片中数十个标记同时进行分析

文献概述
这篇标题为“Microenvironmental reorganization in brain tumors following radiotherapy and recurrence revealed by hyperplexed immunofluorescence imaging”。
研究的主要内容和发现包括:
-
研究背景:
肿瘤微环境(TME)在决定对治疗的反应中起着至关重要的作用,包括细胞景观、空间组织和细胞外基质组成的一系列相互关联的变化。然而,由于当前高维成像技术的限制和肿瘤内部异质性的广泛性,同时从空间角度评估这些变化具有挑战性。 -
HIFI技术介绍:文章介绍了一种名为
Hyperplexed Immunofluorescence Imaging (HIFI)的空间蛋白质组学工作流程,该技术克服了现有方法的局限性。HIFI允许在高倍镜下对脆弱组织切片中的超过45个标记进行同时分析,使用成本效益高的高通量工作流程。 -
研究方法:研究者将HIFI与机器学习特征检测、基于图的网络分析和基于集群的邻域分析相结合,分析了胶质母细胞瘤的微环境对放射治疗的反应,并将其与
脑转移瘤的小鼠模型进行了比较。 -
研究发现:研究表明,胶质母细胞瘤在治疗后经历了免疫细胞群体和结构架构的广泛空间重组织,而脑转移瘤则没有显示出类似的重组织。尽管两种肿瘤模型从放疗中获得了等效的生存益处,但对放疗的反应高度不同。
-
胶质母细胞瘤的治疗:
胶质母细胞瘤是成人最常见的也是最具侵袭性的原发性脑肿瘤,其标准治疗包括手术切除、电离辐射(IR)和基于替莫唑胺的化疗,但这些治疗只会导致短暂的反应。 -
HIFI工作流程:HIFI工作流程旨在易于实施,使用开源软件,无需特殊实验室设备。所有免疫荧光(IF)染色都是使用标准台式方法和试剂手动进行的,所有成像都是使用传统的商业幻灯片扫描显微镜进行的。
-
实验设计:研究使用了RCAS-hPDGF-B; Nestin-Tv-a; Ink4a/Arf KO基因工程小鼠模型(GEMM)来模拟胶质母细胞瘤,并与乳腺癌脑转移模型进行了比较。
-
图像分析:使用HIFI生成的图像进行了后处理、对齐和分析,以识别图像中的任何成像异常,并使用机器学习模型进行结构注释和深度学习细胞分割。
-
结论:HIFI方法是非破坏性的,允许大规模成像,并且适用于高通量分析。该工作流程是低成本和开源的,可以被广泛采纳,并为科学界提供广泛的可访问性。
文章的作者和研究机构包括Spencer S. Watson, Benoit Duc, Ziqi Kang, Axel de Tonnac, Nils Eling, Laure Font, Tristan Whitmarsh, Matteo Massara, iMAXT Consortium, Bernd Bodenmiller, Jean Hausser 和 Johanna A. Joyce,来自瑞士洛桑大学、卡罗林斯卡医学院、苏黎世大学、剑桥大学等机构。
重点关注
图1提供了Hyperplexed Immunofluorescence Imaging(HIFI)工作流程的概述。HIFI是一种用于分析肿瘤微环境的高维成像技术。
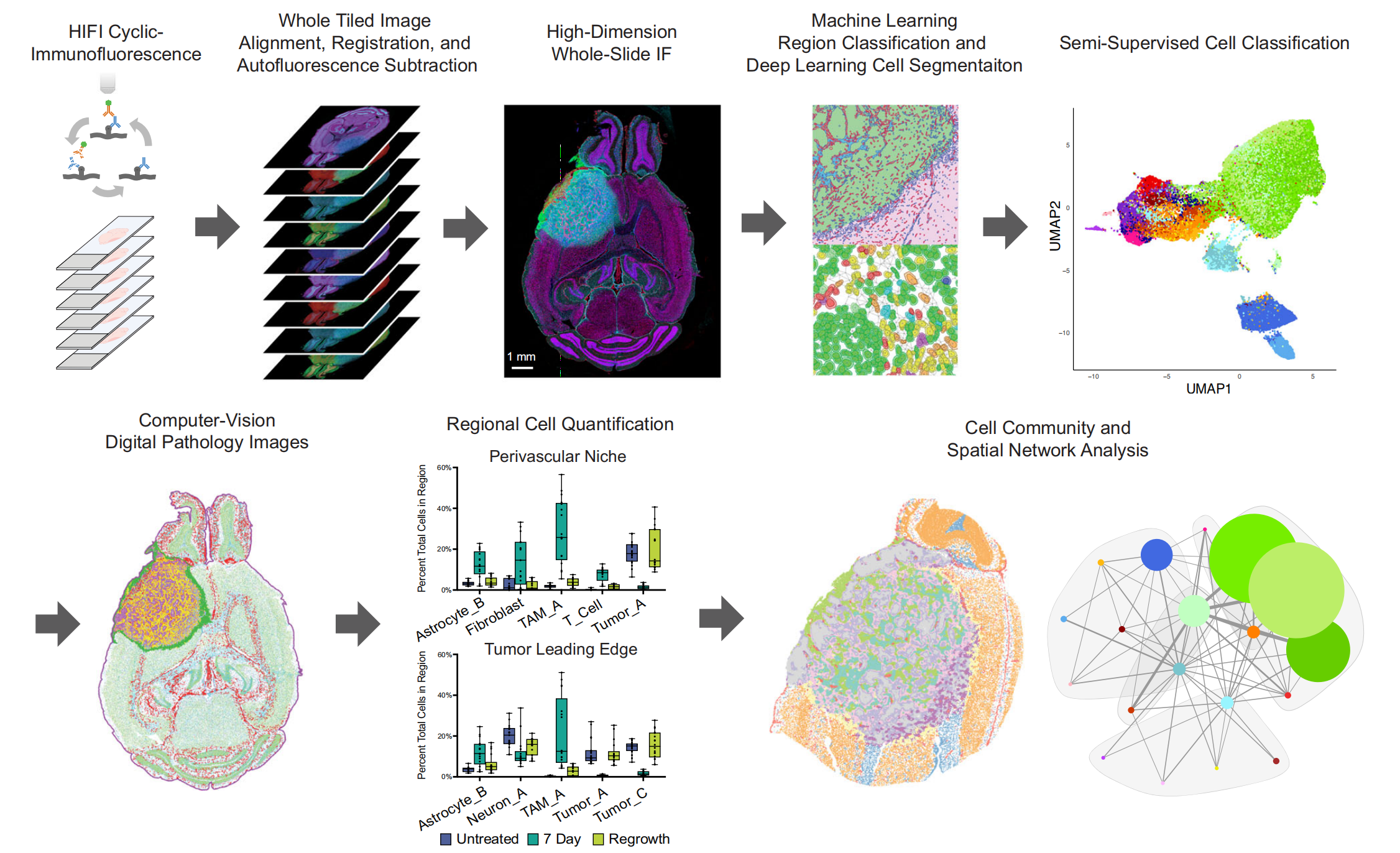
以下是对图1中HIFI工作流程的分析:
-
循环免疫荧光染色(Cyclic Immunofluorescence):这是HIFI工作流程的第一步,涉及使用多个抗体标记物对组织切片进行染色,以便后续进行多重成像分析。
-
图像处理(Image Processing):染色后的组织切片通过扫描显微镜进行成像,然后进行图像处理,包括平铺(tile stitching)、融合(fusion)、背景校正(rolling-ball background subtraction)等步骤,以改善图像质量。
-
图像对齐和注册(Image Alignment and Registration):使用图像处理软件,将不同轮次获得的图像数据进行对齐和注册,创建出覆盖整个组织切片的45维以上(45+ dimensional)的图像。
-
机器学习分类器(Machine Learning Classifiers):利用训练有素的机器学习模型自动识别和注释HIFI图像中的特定区域,如肿瘤边界、血管、肿瘤巢等。
-
深度学习对象检测(Deep-Learning Object Detection):使用深度学习算法对单个细胞进行分割,这是一种高级的图像分析技术,可以从复杂的组织图像中识别和区分单个细胞。
-
半监督细胞分类(Semi-Supervised Cell Classification):将分割后的单个细胞对象通过半监督学习方法进行分类,标记为不同的细胞类型。
-
高注释数字病理图像(Highly-Annotated Digital Pathology Images):将分类后的细胞信息映射回原始图像上,创建出高度注释的数字病理图像,这些图像可以用于进一步的分析。
-
区域细胞组成和空间组织分析(Regional Cellular Composition and Spatial Organizational Analysis):对注释后的图像进行分析,以研究不同区域的细胞组成和空间组织结构。
-
高通量空间实验(High-Throughput Spatial Experiments):HIFI工作流程可扩展至同时处理100多个切片,适用于大规模的空间实验。
总的来说,HIFI工作流程是一个集成了多种先进技术的复杂系统,它允许研究人员在分子和细胞水平上对肿瘤微环境进行全面的空间分析。这种技术的应用可以为肿瘤生物学提供深入的见解,并有助于开发新的癌症治疗策略。
这篇关于人工智能与【肿瘤免疫微环境】结合,探索免疫治疗的新方向|24年6月·顶刊速递·06-02的文章就介绍到这儿,希望我们推荐的文章对编程师们有所帮助!









